25℃时,向20.00 mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液。滴定过程中,溶液的pH与滴入CH3COOH溶液的体积关系如图所示,点②时NaOH溶液恰好被中和。则下列说法中,错误的是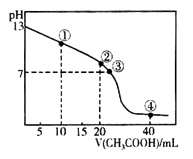
| A.CH3COOH溶液的浓度为0.1 mol·L-1 |
| B.图中点①到点③所示溶液中,水的电离程度先增大后减小 |
| C.点④所示溶液中存在:(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-) |
| D.滴定过程中会存在:c(Na+)> c(CH3COO-)=c(OH-)> c(H+) |
NA代表阿伏伽德罗常数,下列说法正确的是
| A.常温常压下,2g氢气所含有的氢原子的数目为NA |
| B.2molFe与足量的盐酸反应,失去的电子数为0.3NA |
| C.标准状况下,22.4L氯气所含分子数为NA |
| D.0.02 mol/L的NaCl溶液中含有Na+的数目是0.02 NA |
下列说法不正确的是
| A.漂白粉的有效成分为次氯酸钙 |
| B.实验室不能用浓硫酸干燥氨气 |
| C.浓硝酸见光或受热易分解,应避光低温保存 |
| D.检验SO42-时,应先加入BaCl2溶液,有白色沉淀产生时,再加稀硝酸看沉淀是否溶解 |
生产、生活离不开各种化学物质,下列说法正确的是
| A.纳米材料是指一种称为“纳米”的新物质制成的材料 |
| B.光导纤维是由高纯度的硅制成的通信材料 |
| C.王水是浓硝酸和浓盐酸的混合物 |
| D.绿色食品是指不含任何化学物质的食品 |
体积相同,PH值相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量 ( )
A 相同 B HCl多 C CH3COOH多 D无法比较
能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是()
| A.向水中通入二氧化碳气体 | B.将水加热煮沸 |
| C.向水中投入一小块金属钠 | D.向水中加食盐晶体 |