X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是
| A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X |
| B.X、Z两元素能形成原子个数比(X︰Z)为3︰1和4︰2的化合物 |
| C.化合物YW2、ZW2都是酸性氧化物 |
| D.用M单质作阳极,石墨作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀 |
江苏省“十二五”规划指出:“加强生态文明建设,发展循环经济,推广低碳技术,推动绿色增长”。下列做法有悖于生态文明建设的是
| A.加快化石燃料的开采与使用,满足经济快速发展需要 |
| B.禁止使用化学合成的农药,促进绿色食品和有机食品的生产 |
| C.应用高效洁净的能源转换技术,提高能源的利用效率 |
| D.在火电厂推广碳收集和储存技术 |
某醇和醛的混合物0.05 mol,能从足量的银氨溶液中还原出16.2 g银,已知该醇为饱和一元醇,该醛的组成符合CnH2nO,下列结论正确的是
| A.此混合物中的醛一定是甲醛 |
| B.此混合物中的醛、醇可以是任意比 |
| C.此混合物中的醇、醛的物质的量之比是1∶1 |
| D.此混合物中的醇、醛的物质的量之比是3∶1 |
下列实验装置能达到实验目的是(夹持仪器未画出) 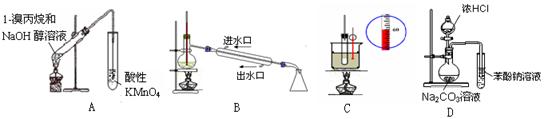
| A.A装置用于检验溴丙烷消去产物 | B.B装置用于石油的分馏 |
| C.C装置用于实验室制硝基苯 | D.D装置可装置证明酸性:盐酸>碳酸>苯酚 |
有人认为CH2=CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br-,然后Br+首先与CH2=CH2一端碳原子结合,第二步才是Br-与另一端碳原子结合。根据该观点如果让CH2=CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是
| A.BrCH2CH2Br | B.ClCH2CH2Cl | C.BrCH2CH2I | D.BrCH2CH2Cl |
绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的是
A.氢气、CO合成甲醇: 2H2+CO CH3OH CH3OH |
B.烯烃与水煤气发生反应:RCH=CH2+CO+H2 RCH2CH2CHO RCH2CH2CHO |
| C.CH4与Cl2反应制取CCl4 |
| D.氯乙烯合成聚氯乙烯 |