右图表示298K时N2与H2反应过程中的能量变化。根据右图叙述正确的是
A.该反应的热化学方程式为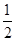 N2(g)+ N2(g)+ H2(g) H2(g) NH3(g),△H=-92kJ·mol-1 NH3(g),△H=-92kJ·mol-1 |
| B.不用催化剂,生成 1molNH3放出的热量为46 KJ |
| C.加入催化剂,生成 1molNH3的反应热减小50 KJ·mol-1 |
| D.曲线b表明加入催化剂降低了反应热,加快了反应速率 |
A、B、C、D、E是短周期五种元素,其原子序数逐渐增大。其中A与C是同族元素,B、E两元素间可形成酸雨,B、D简单离子具有相同的核外电子排布结构。下列说法正确的是()
A.氢化物的沸点:B<E
B.简单离子半径:B>D
C.元素A与元素B不能形成化合物A2B2,但元素B与C能形成化合物C2B2
D.元素D最高价氧化物一定能溶于强碱溶液
某温度下,已知CH3COOH、HClO、H2CO3、H3PO4 电离平衡常数如下表所示,则0.1mol·L-1的下列各溶液pH最大的是()
表:几种弱酸的电离平衡常数
| 酸 |
电离常数 |
| CH3COOH |
Ka=1.8×10-5 |
| HClO |
Ka=3.0×10-8 |
| H2CO3 |
Ka1=4.3×10-7,Ka2=5.6×10-11 |
| H3PO4 |
Ka1=7.5×10-3,Ka2=6.2×10-8,Ka3=2.2×10-13 |
A.CH3COONaB.NaClOC.Na2CO3D.Na3PO4
有四种溶液分别含有下列微粒:①Fe2+②HSO3-③CH2=C(NH2)-COOH④C6H5O-,若分别向其中加入一定量的酸性KMnO4、浓盐酸或KOH固体,均能使微粒物质的量明显减少的是()
| A.①② | B.①④ | C.②③ | D.②④ |
有一个铝罐充满X气体,当向其中加入足量的Y溶液并迅速将开口密封,发现该铝罐先瘪下,后又慢慢鼓起。则X、Y可能分别为()
①Cl2、NaOH②CO2、NH3.H2O③NH3、浓H2SO4④NH3、稀H2SO4
| A.①③ | B.①② | C.②③ | D.①④ |
下列反应的离子方程式书写正确的是()
| A.硫酸铜溶液中加过量的氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ |
| B.用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+=Ca2++CO2↑+H2O |
| C.苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O=C6H5OH+HCO3- |
| D.用碘化钾淀粉溶液检验亚硝酸钠中NO2-的存在:NO2-+2I-+2H+=NO↑+I2+H2O |