在标准状况下,称量一个充满氯气的容器质量为74.6g,若改充氮气,其质量为66g,则容器的容积为
| A.11.2L | B.5.6L | C.4.48L | D.2.24L |
仔细分析下列表格中烃的排列规律,判断排列在第 15 位烃的分子式是
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
…… |
| C2H2 |
C2H4 |
C2H6 |
C3H4 |
C3H6 |
C3H8 |
C4H6 |
C4H8 |
C4H10 |
…… |
A.C6H12 B.C6H14 C.C7H12 D.C7H14
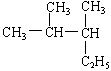 的名称是
的名称是
| A.2—甲基—3—乙基丁烷 | B.3,4—二甲基戊烷 |
| C.2,3—二甲基—4—乙基丙烷 | D.2,3—二甲基戊烷 |
下列说法正确的是
| A.35Cl和37Cl互称为同位素 |
B.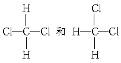 互称为同分异构体 互称为同分异构体 |
| C.H2、D2和T2互称为同素异形体 |
| D.C2H4与C4H8一定能互称为同系物 |
下列关于原子结构、元素性质的说法正确的是( )
| A.非金属元素组成的化合物中只含共价键 |
| B.ⅠA族金属元素是同周期中金属性最强的元素 |
| C.同种元素的原子均有相同的质子数和中子数 |
| D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是
A.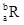 |
B. |
C.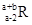 |
D. |