(12分)某化学实验小组需用480 mL 0.5 mol/L的硫酸铜溶液,请回答下列问题:
(1)如果用胆矾(CuSO4·5H2O)来配制,需用胆矾的质量为__________g。
(2)下面是配制硫酸铜溶液过程中的5个操作步骤:①向盛有胆矾的烧杯中加入20 mL蒸馏水使其溶解;②继续往容量瓶中加蒸馏水,至液面距刻度线1~2 cm处;③将烧杯中的溶液沿玻璃棒注入500 mL容量瓶中;④向烧杯中加入少量的蒸馏水,洗涤烧杯内壁和玻璃棒2~3次后移入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;⑤改用胶头滴管加蒸馏水至刻度线,盖好瓶塞,反复上下颠倒,摇匀。正确的操作顺序为__________________(填序号)。
(3)上述操作中,①、③都用到玻璃棒,其作用分别为__________、___________。
(4)下列操作会导致所配硫酸铜溶液物质的量浓度偏低的是___________(填序号,下同);对所配溶液物质的量浓度无影响的是__________。
①在烧杯中搅拌溶液时,有少量液体溅出
②定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线
③容量瓶使用前未进行干燥
④所使用的容量瓶刚用某种浓度的硫酸铜溶液润洗过
⑤定容后,塞好瓶塞摇匀,装入用蒸馏水洗净的试剂瓶中
⑥没有洗涤溶解时所用的烧杯和玻璃棒
现有等物质的量的Mg和Al的混合物a g与100 ml盐酸反应,(气体体积均以标准状况计算)
(1)、该混合物中Mg和Al的质量比为
(2)、如果金属与盐酸恰好完全反应,则盐酸的浓度为
(3)、如果反应后金属有剩余,盐酸不足,要计算生成H2的体积,还需要知道
在容积为10L的密闭容器中,通入40molN2和120molH2,在一定条件下进行反应,2s后达到平衡状态,此时N2的浓度是2mol/L,试求:
(1)用H2的浓度变化表示的2s内的平均反应速率为多少?
(2)N2的转化率为多少?
(3)平衡时NH3的体积分数为多少?(要求有计算过程)
把足量的铁粉投入到100 mL 1.0 mol/L的盐酸中,充分反应后能得到标准状况下氢气的体积是多少?(要求有计算过程)
为了测定草酸晶体(H2C2O4·xH2O)中的x值,进行如下实验
(1)称取Wg草酸晶体,配成100.00mL溶液
(2)取25.00mL所配溶液于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L—1的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
试回答:
①实验中,需要的仪器有(填序号),还缺少的仪器有(填名称)
| A.托盘天平(带砝码、镊子) | B.滴定管 | C.100mL的量筒 | D.100mL的容量瓶 |
E、烧杯 F、漏斗 G、锥形瓶 H、玻璃棒 I、药匙 J、烧瓶
②实验中,标准液KMnO4溶液应装在式滴定管中,因为
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的x的值会(填偏大、偏小、无影响)。
④在滴定过程中若用去amol·L—1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为mol·L—1,由此,x=。
⑤若滴定终点读数时俯视刻度,则计算的x值会(填偏大、偏小、无影响)。
下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见的物质。 反应①②是置换反应,反应①②③均在高温下进行。A在常温下为液态,C有磁性,F既能溶于NaOH又能溶于HCl。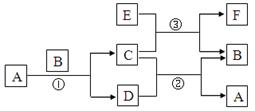
⑴A的电子式
⑵写出反应①的化学方程式
⑶写出F与浓强碱液反应的离子方程式
⑷C、E的混合物在工业上用于钢轨焊接,写出反应③的化学方程式: