下列事实中,不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O  HBr+HBrO当加入AgNO3(s)后溶液颜色变浅 HBr+HBrO当加入AgNO3(s)后溶液颜色变浅 |
B.2NO2(g)  N2O4(g)(正反应放热),升高温度可使体系颜色加深 N2O4(g)(正反应放热),升高温度可使体系颜色加深 |
C.反应CO+NO2 CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 |
D.合成氨反应N2+3H2 2NH3(正反应放热)中使用催化剂 2NH3(正反应放热)中使用催化剂 |
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。T1℃时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P1。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是( )
CH3OH(g)+H2O(g)ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P1。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是( )
| A.曲线II对应的条件改变是增大压强 |
| B.T2℃时,上述反应平衡常数为0.42,则T2>T1 |
| C.在T1℃,若起始时向容器中充入 5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆) |
D.在T1℃,若起始时向容器中充入4.5molCO2、6mol H2 ,平衡时容器内压强p=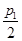 |
下列图中的实验方案,能达到实验目的的是()
| A |
B |
C |
D |
|
| 实验方案 |
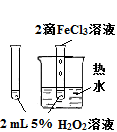 |
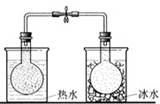 将NO2球浸泡在冰水和热水中 |
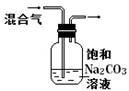 |
 |
| 实验 目的 |
验证FeCl3对H2O2分解反应有催化作用 |
探究温度对平衡 2NO2  N2O4的影响 N2O4的影响 |
除去CO2气体中混有的SO2 |
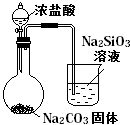
比较HCl、H2CO3和H2SiO3的酸性强弱 |
下列示意图与对应的反应情况符合的是()
| A.向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量 |
| B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量 |
| C.向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量 |
| D.向NaAlO2溶液中逐滴加入盐酸至过量 |
下列叙述正确的是()
①久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生②若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应④玻璃、水泥、水晶项链都是硅酸盐制品⑤液态氟化氢中存在氢键,所以其分子比氯化氢更稳定⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质
| A.①⑥ | B.①④⑥ | C.②③④ | D.④⑤⑥ |
下列物质转化在给定条件下能实现的是()
①Al2O3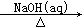 NaAlO2(aq)
NaAlO2(aq) 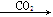 Al(OH)3
Al(OH)3
②S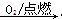 SO3
SO3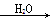 H2SO4
H2SO4
③饱和NaCl(aq)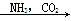 NaHCO3
NaHCO3 Na2CO3
Na2CO3
④Fe2O3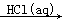 FeCl3(aq)
FeCl3(aq)  无水FeCl3
无水FeCl3
⑤MgCl2(aq) Mg(OH)2
Mg(OH)2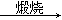 MgO
MgO
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |