我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5+xLi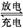 LixV2O5。下列说法合理的是
LixV2O5。下列说法合理的是
| A.电池在放电时,Li+向负极移动 |
| B.锂在放电时作正极,充电时作阳极 |
| C.该电池充电时阳极的反应为LixV2O5 _ xe-=V2O5 + xLi+ |
| D.V2O5只是锂发生反应的载体,不参与电池反应 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.一定条件下,0.1mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
| B.标准状况下,20g D2O分子中所含中子数为10NA |
| C.标准状况下,22.4L Cl2完全溶于水形成氯水时,转移电子数为NA |
| D.氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA |
下列说法中,正确的是
| A.Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物 |
| B.SiO2、CO2均为酸性氧化物,均能与NaOH溶液反应生成盐和水 |
| C.FeO、Fe2O3均为碱性氧化物,与氢碘酸反应均只发生复分解反应 |
| D.将Fe(OH)3胶体和泥水分别进行过滤,分散质均不能通过滤纸孔隙 |
向一定量的Cu、Fe2O3的混合物中加入100 mL 2 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
| A.3.2 g | B.2.4 g | C.1.6 g | D.0.8 g |
下列物质的转化在给定条件下能实现的是
A. |
B. |
C.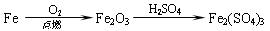 |
D.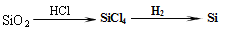 |
下列有关化学用语表示正确的是
| A.二氧化硅的分子式:SiO2 |
B.熔融状态下硫酸氢钾的电离方程式:KHSO4  K++HSO4- K++HSO4- |
C.甲基的电子式: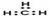 |
| D.HClO的结构式:H-Cl-O |