下列离子方程式的写法正确的是:
| A.单质钠与水的反应:Na+H2O==Na++OH-+H2↑ |
| B.氢气在氯气中燃烧:H2+Cl2==2H++2Cl- |
| C.小苏打治疗胃酸过多:H++ HCO3-==H2O+CO2↑ |
| D.用氯化铁溶液腐蚀铜箔制造印刷电路板:Fe3++Cu==Fe2++Cu2+ |
某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
| A.加入NaCl可以使溶液由a点变到b点 |
| B.向AgCl饱和溶液中加入水, C(Ag+)增大 |
| C.d点无AgCl沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
在醋酸与氢氧化钠溶液的反应过程中,溶液中的相关离子浓度呈现出下列排列顺序: c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。满足该条件的反应是
| A.0.01mol·L-1的CH3COOH与pH=12的NaOH溶液等体积混合 |
| B.0.2 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合 |
| C.CH3COOH溶液与NaOH溶液混合后所得溶液的pH=7 |
| D.0.1 mol·L-1的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合 |
下列热化学方程式或离子方程式中,正确的是
A.甲烷的标准燃烧热为-890.3kJ·mol-1 ,则甲烷燃烧的热化学方程式可表示为: ,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1 |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放19.3kJ,其热化学方程式为:N2(g)+3H2(g) 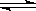 2NH3(g)△H=-38.6kJ·mol-1 2NH3(g)△H=-38.6kJ·mol-1 |
C.氯化镁溶液与氨水反应: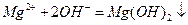 |
D.氧化铝溶于NaOH溶液: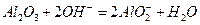 |
下列方程式书写正确的是
A.CO32-的水解方程式:CO32-+2H2O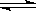 H2CO3+2OH- H2CO3+2OH- |
B.H2SO3的电离方程式H2SO3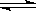 2H++SO32- 2H++SO32- |
C.HCO3- 在水溶液中的电离方程式:HC O3-+H2O O3-+H2O H3O++CO32- H3O++CO32- |
D.CaCO3的电离方程式:CaCO3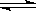 Ca2++CO32- Ca2++CO32- |
下列说法不正确的是
| A.属于放热和熵增加的反应,就更易自发进行 |
| B.溶液在稀释过程中,溶液中的阴、阳离子浓度都减小 |
| C.对某可逆反应而言,其平衡常数K值越大,反应物的转化率也越大 |
| D.向2.0 mL浓度均为0.1 mol/L的KCl、KI混合溶液中滴加1~2滴0.01 mol/L AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大 |