所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
| |
Na |
Cu |
Al |
Fe |
| 熔点(0C) |
97.5 |
1083 |
660 |
1535 |
| 沸点(0C) |
883 |
2595 |
2200 |
3000 |
你判断其中不能形成合金的是
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na
向含a mol氯化铝的溶液中加入含b mol氢氧化钾溶液,生成沉淀物质的量可能是()
①a mol ②b mol ③ a/3 mol ④b/3 mol ⑤0 mol ⑥(4a-b) mol
| A.①②③ | B.①②④⑤ | C.①②④⑤⑥ | D.①③④⑤⑥ |
下列物质久置于空气中,均可与空气中某些成分发生化学反应,为确定下列置于空气中的物质是否变质,所选检验试剂(括号内)不能达到目的的是()
| A.Na2SO3溶液(BaCl2溶液) | B.FeSO4溶液(KSCN溶液) |
| C.漂白粉(稀盐酸) | D.NaOH溶液[Ba(OH)2溶液] |
下列反应的离子方程式书写正确的是()
| A.小苏打和盐酸反应:CO32-+2H+=CO2↑+H2O |
| B.铁粉与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C.氢氧化钡溶液与明矾溶液反应:Ba2++SO42-=BaSO4↓ |
| D.氧化铝溶于强碱:Al2O3+2OH-=2AlO2-+H2O |
自来水直接用氯气消毒杀菌,因生成极少量有机氯而对不人体不利。高铁酸钾( K2FeO4)是一种新型的自来水处理剂,高铁酸钾( K2FeO4)遇水后会生成Fe3+水解成胶体,高铁酸钾( K2FeO4)的性质和作用是()
| A.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 |
| B.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌 |
| C.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质 |
| D.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质 |
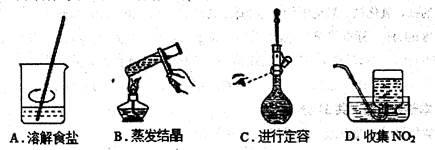
图示的下列有关实验原理或操作正确的是()