已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。已知:
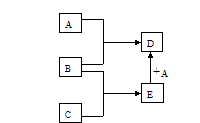
①A常温下为黄绿色的气体单质。
②B为一种常见变价金属单质,在冷的浓硫酸中会被钝化。
③C的水溶液是一种无氧酸,且C的组成中含有与A相同的元素。
请回答下列问题:
(1)A的化学式为 ,构成非金属单质A的元素的最高价氧化物的分子式为 ,C的名称为 。
(2)A与水反应的化学方程式为 。
(3)A与E反应生成D的离子方程式为 。
(4)在E的水溶液中加入足量氢氧化钠溶液,观察到的现象为 。
已知R—CH===CH2+HX―→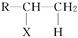 (主要产物)
(主要产物)
下列转化中A、B分别是化学式C3H7Cl的两种同分异构体。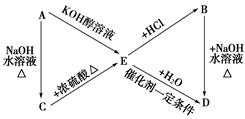
请根据转化关系和反应条件,判断并写出:
(1)A、B、C、D、E的结构简式。
(2)由E转化为B,由D转化为E的化学方程式。
【原创】(14分)C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实。根据以下化学反应框图填空:
(1)写出A的结构式 ;B、D的结构简式B: D: ;
(2)写出碳化钙与水反应制取A的化学方程式 ;
苯和液溴反应生成E的化学方程式 ,其反应类型为 。
B→C的化学方程式 ,其反应类型为 。
(3)除去溴苯中的溴可选用的试剂 ,分离方法 。
(共10分)下列框图是八种有机化合物的转化关系。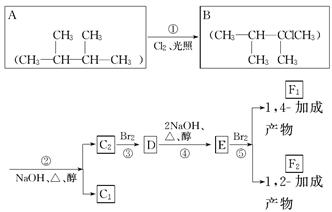
请回答下列问题:
(1)根据系统命名法,化合物A的名称是________。
(2)上述框图中,①是________反应,③是________反应。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:____________。
(4)C1的结构简式是________;F1的结构简式是________。F1和F2的关系为________。
【原创】1,4-环己二醇是合成乙二酸-1,4-环己二醇酯的重要原料,可通过下列路线合成(某些反应的反应物和反应条件未列出):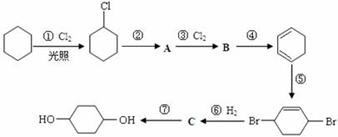
(1)上述合成过程中没有涉及的反应类型是
| A.加成 | B.消去 | C.氧化 | D.取代 |
(2)写出下列反应的条件及反应类型反应②:___ , ;
反应⑦:______, 。
(3)写出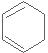 与Br21:1加成的另一种产物的结构简式: 。
与Br21:1加成的另一种产物的结构简式: 。
(4)写出反应④的化学方程式_________________________________。
(14分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。
请按要求回答下列问题:
(1)若B、D为短周期同一主族的非金属单质,则反应(III)中氧化产物与还原产物的物质的量之比为___。
(2)若A、B、C均为短周期元素组成的化合物,且溶液都显碱性,D为植物光合作用必须吸收的气体,物质A中化学键的类型为___________,相同温度下的溶解度B_________C(填“大于、小于、等于”)。
(3)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则检验B溶液中阳离子的试剂为_________;C的溶液保存时,常加入D的目的是__________________。
(4)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,写出反应(III)的离子方程式是_______________________________;符合条件的D物质可能是_______________(填序号)。
①硫酸②碳酸 ③氢氧化钠 ④一水合氨⑤氯化钡