用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④ ⑤转移、洗涤 ⑥定容、摇匀 ⑦装瓶贴标签
完成下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是 。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中_______________________;
B.容量瓶用蒸馏水洗涤后残留有少量的水________________;
C.所用过的烧杯、玻璃棒未洗涤________________;
D.定容时俯视刻度线________________。
草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如下图所示
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的 H2SO4的质量比2︰1.25)
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
(1)上图实验装置中仪器甲的名称为:______________________________。
(2)检验淀粉是否水解完全所需要的试剂为:________________________。
实验Ⅱ:探究草酸的不稳定性
甲组同学查阅资料得知:草酸晶体(H2C2O4·2H2O)100℃开始失水,100.5℃左右分解产生H2O、CO和CO2。试用下图中提供的仪器和试剂,设计一个实验,证明草酸晶体分解得到的混合气体中含有H2O、CO和CO2(加热装置和导管等在图中略去,部分装置可以重复使用)。
请回答下列问题:
(3)仪器装置连接顺序为:C→_______→F→_______→_______→D→A→F。
(4)若实验结束后测得A管质量减轻4.8g,则需分解草酸晶体的质量为__________g。
(5)乙组同学查阅资料发现:草酸酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均是白色不溶物。通过进一步研究认为,草酸蒸汽与石灰水反应生成草酸钙白色沉淀,对实验有干扰,因此提出需要在检验CO2装置之前增加一个装有_________的洗气装置。(填写字母编号)。
| A.水 | B.氢氧化钠溶液 | C.碳酸钠溶液 | D.饱和碳酸氢钠溶液 |
实验Ⅲ:探究草酸与酸性高锰酸钾的反应
(6)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有___________________性。
(7)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下对比实验;
由此你认为溶液褪色总是先慢后快的原因是___________________________________。
(8)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。钒元素广泛分散于各种矿物中,钾钒铀矿的主要成分可用化学式表示为 K2H6U2V2O15,测定其中钒元素含量的方法是:先把矿石中的钒元素转化为V2O5,V2O5在酸性溶液里转化为 ,再用标准草酸溶液滴定。总反应可表示为:
,再用标准草酸溶液滴定。总反应可表示为:
□ +□H2C2O4+□H+→□
+□H2C2O4+□H+→□ +□CO2+□H2O
+□CO2+□H2O
①请将上述反应配平(填写系数即可):_______________________________。
②现有钾钒铀矿样品10.2g,用上述方法来测定钒的含量,结果消耗0.9g草酸,那么此钾钒铀矿中钒元素的质量分数是_________________。
主要用于煤矿井下急救。某兴趣小组拟选用如下装置制备超氧化钾(部分夹持仪器已略去)。
请回答下列问题:
(1)请选择必要的装置,按气流方向的连接顺序为_____________(填仪器接口的字母)。
(2)请根据完整的实验装置,完成下列实验步骤:①_____________________;②装入药品,打开分液漏斗活塞;③持续通入气体一段时间后,点燃酒精灯进行反应;④反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;⑤拆除装置,取出产物。
(3)数据记录如下:
根据数据计算可得实验式KOx,则x=____________________。
(4)超氧化钾可吸收二氧化碳,并生成氧气,因此可以作为飞船、潜艇等密闭系统的氧气再生剂。写出超氧化钾与二氧化碳反应的化学方程式:__________________________。与过氧化钠相比,其优点是______________________________。
已知离子反应:Fe3++3SCN- Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL l mol·L-1FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成红
色。
②取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气
体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。
气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变
浑浊的无色无味气体D。
⑤取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为_________________;E的化学式为___________________。
(2)混合气体A的成分是___________________(填化学式)。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,则实验②中反应时被氧化的元素是____________(填元素符号)。根据元素C、S、N的原子结构和共价键的相关知识推断出SCN-的结构式为_________________。
(4)实验②中反应的离子方程式为___________________________________________。
(5)该兴趣小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意_________________________________________________________________.
铁触媒(铁的某氧化物)是工业合成氨的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列流程测定铁触媒的含铁量,确定其组成。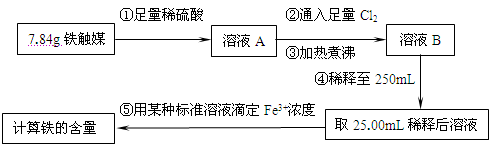
(1)步骤④后面需用(填仪器名称)取25.00mL稀释后溶液。
(2)因为通入Cl2不足量,“溶液B”中还含有会影响测定结果。
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol·L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL·L-1KSCN溶液
| 实验操作 |
实验现象与结论 |
方案二:用下列实验方法测定铁触媒的含铁量,确定其组成。
(4)“干燥管C”的作用是。
(5)称取15.2g铁触媒进行上述实验。充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为。(相对原子质量:C-12 O-16Fe-56)
ClO2作为消毒剂在消毒过程中对人体无毒无害,具有广泛的应用前景。某同学用下图所示的装置制备ClO2气体,反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)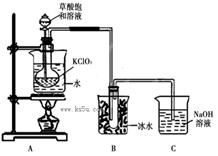
已知信息:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃。与碱反应和氯气相似。
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。
(1)制备ClO2的化学方程式:2KClO3+H2C2O4= 2KHCO3+2ClO2↑;下列说法正确的是
| A.KClO3在反应中得到电子 |
| B.ClO2是氧化产物 |
| C.H2C2O4在反应中失去电子 |
| D.1mol KClO3参加反应有2mol电子转移 |
(2)A装置中还缺少的一样仪器名称是__________,
若将A中烧杯去掉,让烧瓶直接加热是否可以,为什么?_________________________。
(3)C装置吸收尾气后,溶液中含有NaOH、Na2CO3等溶质,该同学认为C中还可能含有NaClO2、NaClO3,试分析可能的原因,并写出有关化学方程式________。
(4)实验室还可通过以下反应制得ClO2:
KClO3+H2C2O4+H2SO4= ClO2↑+K2SO4+CO2↑+H2O.
配平上述方程式。0.5 mol KClO3参加反应有个电子转移。