下列说法中,正确的是
| A.1 mol NO的质量是30g |
| B.标准状况下,1 mol H2O的体积是22.4 L |
| C.17 g NH3含有的氢原子总数为6.02×1023 |
| D.100 mL 0.1 mol/L Na2CO3溶液中,Na+的 物质的量为 0.01 mol |
根据下图,下列判断中正确的是( )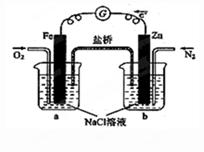
| A.向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
| B.烧杯b中发生反应为2Zn-4eˉ =2Zn2+ |
| C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D.烧杯a中发生反应O2 + 4H++ 4eˉ = 2H2O,溶液pH降低 |
下列有关物质浓度关系的描述中,正确的是( )
| A.25℃时,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42—)>c(OH—)=c(H+) |
| B.25℃时,NaB溶液的pH=8,c(Na+) + c(B-)=9.9×10-7mol·L-1 |
| C.0.1mol·L-1的NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
| D.同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3) |
某pH=1的X溶液中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
下列说法正确的是( )
| A.气体A是NO2 |
| B.X中肯定存在Fe2+、A13+、NH4+、SO42- |
| C.溶液E和气体F不能发生化学反应 |
| D.X中不能确定的离子是 A13+和C1- |
已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1 P4(s)+10Cl2(g)=4PCl5(g) ΔH=bkJ·mol-1,P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是( )
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH |
C.Cl-Cl键的键能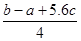 kJ·mol-1 kJ·mol-1 |
D.P-P键的键能为 kJ·mol-1 kJ·mol-1 |
食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚。其结构简式如下图。有关瘦肉精的说法不正确的是( )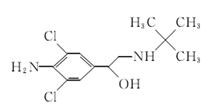
| A.化学式为C12H18ONH2C12 |
| B.遇FeCl3溶液发生显色反应 |
| C.属于芳香族化合物 |
| D.可以发生取代、加成、水解、酯化、消去反应 |