设NA为阿伏伽德罗常数的值,下列叙述正确的是
| A.标准状态下,33.6L氟化氢中含有氟原子的数目为1.5 NA |
| B.盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol |
| C.18 g D2O中含有的质子数目为10NA |
| D.标准状况下,11.2LSO3所含的分子数为0.5NA |
下列说法正确的是
| A.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| B.Ⅵ族元素的氢化物中,稳定性最好的其沸点也最高 |
| C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
| D.第三周期元素的离子半径从左到右逐渐减小 |
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生反应的化学方程式为:5KClO3+6P="3" P2O5+5KCl,则下列有关叙述错误的是
| A.上述反应是放热反应 |
| B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾) |
| C.该反应氧化剂与还原剂物质的量之比为6:5 |
| D.上述反应中消耗3molP时,转移电子的物质的量为15mol |
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)===Na2CO3(s)+1/2O2(g)ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是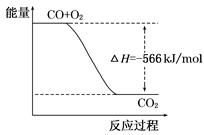
| A.CO的燃烧热为283 kJ |
| B.右图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)===2Na2CO2(s)+O2(g) ΔH>-452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |
白磷与氧可发生如下反应:P4+5O2===P4O10.已知断裂下列化学键需要吸收的能量分别为:P—P a kJ/mol、P—O b kJ/mol、P==="O" c kJ/mol、O==="O" d kJ/mol.
根据右图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是
| A.(4c+12b-6a-5d) kJ/mol |
| B.(6a+5d-4c-12b) kJ/mol |
| C.(4c+12b-4a-5d) kJ/mol |
| D.(4a+5d-4c-12b) kJ/mol |
能正确表示下列反应的离子方程式是
| A.向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO |
| B.向次氯酸钙溶液通入SO2:Ca2++2ClO-+H2O+SO2===CaSO3↓+2HClO |
| C.氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+HCO3—===CaCO3↓+H2O |
| D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3—===3Fe3++2H2O+NO↑ |