在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知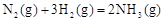
 kJ·mol
kJ·mol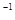 )
)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol N2、3mol H2 |
2mol NH3 |
4mol NH3 |
NH3的浓度(mol·L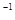 ) ) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
 |
 |
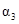 |
下列说法正确的是
A. B.α1+α3="1" C.
B.α1+α3="1" C.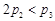 D.
D.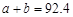
30 mL一定浓度的硝酸溶液与5.44g铜片反应,当铜片全部反应完毕后,共收集到
气体2.24 L(标准状况下),则该硝酸溶液的物质的量浓度至少为()
| A.9 mol/L | B.8 mol/L | C.5 mol/L | D.10 mol/L |
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是:①NO和NO2,②NO2和O2,③NH3和N2,现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是()
| A.V1>V2>V3 | B.V1>V3>V2 | C.V2>V3>V1 | D.V3>V1>V2 |
对下列实验现象的解释正确的是( )
| 选项 |
实验现象 |
解释 |
| A |
C12可使含有酚酞的氢氧化钠溶液褪色 |
氯气具有漂白性 |
| B |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO42- |
| C |
SO2可使酸性KMnO4溶液褪色 |
SO2具有漂白性 |
| D |
浓硝酸在光照下颜色变黄 |
浓硝酸不稳定 |
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是()
| A.Z的最高价氧化物在常温的条件下能与W的氢化物的水溶液反应 |
| B.原子半径由小到大的顺序:X< Y < Z< W |
| C.Y单质在一定条件下可以与氧化铁发生置换反应 |
| D.室温条件下不可以用Y制的容器盛放浓硫酸 |
设NA为阿伏加德罗常数,下列叙述中正确的是()
| A.0.3mol NO2气体溶于足量水中充分反应转移的电子总数为0.2 NA |
| B.7.8g Na2O2固体中含有的离子总数为0.4NA |
| C.标准状况下,22.4L SO3与足量水充分反应生成的H+的总数为2NA |
| D.0.5mol Fe与过量的硫在加热的条件下充分反应得到的电子总数为1.5NA |