【2015年上海市】甲同学设计了如下实验装置验证一氧化碳的部分性质并验证产物。实验时,在点燃B处酒精 灯之前先通入一氧化碳排出装置中的空气,然后继续实验。
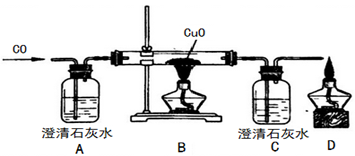
①B中反应的化学方程式是 ,该反应的还原剂是 。
②实验过程中,C中的现象是 ,D处点燃的目的是 。
③对该实验的分析正确的是 (选填编号)
a、实验结束时应先熄灭B处酒精灯
b、C中增加的质量与B中固体减少的质量相等
c、反应开始后通入0.1mol一氧化碳可生成0.1mol铜
d、反应结束后继续通入一氧化碳的目的是防止铜被氧化
④甲同学认为A装置用于证明一氧化碳不能和石灰水反应,乙同学认为省略A可达到同样的目的,理由是 。
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ. 写出该中和反应的化学方程式:。
Ⅱ. 探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;
猜想三:。
【查阅资料】氯化钙溶液呈中性。
【进行实验】
实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象:结论:猜想一不正确
实验步骤:取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量
实验现象: 结论:猜想二不正确,猜想三正确
【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,还可使用(填序号)完成该实验,具体操作方法是。
a.pH试纸 b.铜c.无色酚酞试液 d.硝酸银溶液
(3)烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是(写一条)。要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的一种物质,该物质的化学式为。
学习了金属的化学性质后,某兴趣小组进行了如下实验:将足量镁条加入到氯化铁溶液中,观察到镁条表面有气泡产生,一段时间后,有黑色固体粉末生成.
【提出问题】产生气体是什么物质?
【作出猜想】猜想一:可能是氧气;
猜想二:可能是氢气;
猜想三:可能是二氧化碳.
【交流讨论】大家思考后,一致认为猜想三不合理,其理由是。
【实验与结论】
| 实验步骤 |
现象 |
结论 |
| ①先用试管收集该气体,再将带火星的木条伸入试管 |
猜想一不成立 |
|
| ②用尖嘴导管将气体导出并引燃,同时在上方放一块干冷的玻璃片 |
该气体能燃烧,且玻璃片上有出现 |
猜想二成立 |
【继续探究】用pH试纸测得氯化铁溶液pH约为2,说明氯化铁溶液中含有较多的离子。
实验室有一瓶保存不当的试剂(如右图所示),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。小华等几位同学很感兴趣,决定对其成分进行探究。
【提出问题】这瓶试剂溶质是什么?
【交流研讨】根据受损标签的情况判断,这瓶试剂不可能是(填字母序号)。
A.酸 B.碱 C.盐
【查阅资料】①初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
②Na2CO3、NaHCO3溶液都呈碱性。NaCl溶液呈中性。
③室温下(20℃)时,4种物质的溶解度的数据如下。
| 物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
| 溶解度/g |
36 |
109 |
215 |
9.6 |
【得出结论】小华根据试剂瓶上标注和上表溶解度数据判断,这瓶试剂不可能是。
【猜想与实验】①可能是溶液;②可能是NaOH溶液;③可能是NaCl溶液。
(1)小亮用洁净的玻璃棒蘸取该溶液,滴到干燥的pH试纸上,测得pH=11,他判断该溶液不可能是
(2)小强为了确定该溶液的成分,进行了如下实验。
| 操作步骤 |
实验现象 |
结论及化学方程式 |
| 步骤一: 取样品于试管中,滴加足量 |
产生大量的气泡 |
猜想①正确。 步骤一发生反应的化学方程式是 |
| 步骤二:把产生的气体,通入 |
【质疑】小华则不同意小强的观点,认为溶液中有Na2CO3还可能有NaOH。请你帮助他完成以下探究方案:
| 探究步骤 |
预计现象 |
结论 |
| 步骤一:取样品于试管中,向其中滴加足量的溶液并过滤 |
产生白色沉淀 |
溶液中既含Na2CO3,又含有NaOH |
| 步骤二:向上述滤液中滴加酚酞试液 |
酚酞试液变色 |
【反思】NaOH溶液会因接触空气而变质,写出该反应的化学方程式;
以下是某同学进行的两个实验探究
实验一:从含少量铜粉的银、锰(Mn)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为:A、B、C,并设计了如下流程:
(1) A、B、C三种金属的活动性由强到弱的顺序为
(2)金属C是,操作a的名称是。
(3)已知A的硫酸盐中A元素显+2价,请写出步骤①的反应的化学方程式:。
实验二:研究镁条与稀盐酸反应过程中的能量变化以及反应速率的变化步骤:
⑴ 实验前需对镁条进行打磨,目的是.
⑵ 检查图1装置的气密性。
⑶ 将镁条放入锥形瓶中,将注射器中的稀盐酸全部压入锥形瓶中,使之反应,发生反应的化学方程式为。
⑷ 观察注射器活塞运动变化情况,绘制出注射器内收集到的气体体积变化与时间关系的图像如图2所示。则t1~t2时间内反应速率逐渐减慢的主要原因是.
t2~t3时间内注射器内气体体积逐渐减少的原因。
(1)化学与生活密切相关.妈妈为了给小明增加营养,制定了如表所示的食谱.
| 主食 |
米饭 |
| 副食 |
红烧肉、糖醋鱼、排骨汤 |
| 饮料 |
加钙牛奶 |
a.米饭中主要含有的营养素是(填“糖类”或“油脂”).为了使营养均衡,你建议应该增加的食物是(填“蔬菜”或“火腿肠”)
b.小明妈妈在厨房用到的下列物品中,主要材料属于合成材料的是(填序号)
①铁锅 ②棉布围裙 ③塑料手套.
c.在某活动中,小明同学不小心被蚂蚁咬了(蚂蚁毒液呈酸性),很痒,用下列物质涂抹可以减轻痛苦的是(填字母)
A.食醋B.肥皂液C.汽水
(2)小明在查阅资料时看到这样一段话:“二氧化硫能使紫红色KMnO4溶液变成无色溶液,反应方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2 .
.
①方程式中最后一种物质的化学式印刷不清楚,小明根据上下文了解到该物质是一种常见的酸,请根据已学知识推测其化学式:,高锰酸钾中Mn元素化合价为,5SO2中“5”的含义是。
②信息提示:硫酸钾是由K+和SO42-构成.硫酸钾溶液呈无色,盐溶液的颜色通常是由构成它的离子决定的.根据资料及信息提示,KMnO4溶液呈现的紫红色可能是由(填离子符号)离子表现出来的.
(3)现将H2SO4、Ba(OH)2、Na2CO3三种物质同时加入到足量的水中,充分反应后过滤,得白色沉淀B和无色溶液A,经测定溶液pH<7.
信息:⑴硫酸钡不溶于水也不溶于酸⑵碳酸钡不溶于水,但能溶于酸
据此判断:溶液A中一定存在粒子有白色固体B属于(填“纯净物”或“混合物”).