常温下,水溶液中能大量共存的一组离子是
| A.与Al反应放出氢气的溶液中:Na+、H+、NH4+、NO3— |
| B.在c(H+)=1.0×10—13mol/L的溶液中:Na+、K+、AlO2—、CO32— |
| C.澄清透明的溶液中:Fe3+、Mg2+、NO3—、S2— |
| D.在pH=1的溶液中:NH4+、K+、ClO—、Cl— |
下列有关化学用语表示正确的是()
A.对硝基甲苯的结构简式: |
B.CH2F2的电子式: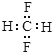 |
C.中子数为16的硫原子: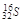 |
| D.乙炔的最简式:CH |
石墨烯是一种由碳原子组成六角形成蜂巢晶格的平面薄膜,其结构模型见右图。下列关于石墨烯的说法正确的是 ()
| A.是一种新型化合物 | B.与石墨互为同位素 |
| C.晶体中碳原子键全部是碳碳单键 | D.是一种有发展前途的导电材料 |
现加热5.00gNa2CO3和NaHCO3的混合物,使NaHCO3完全分解,混合物质量减少了0.31g,则原混合物中Na2CO3的质量分数是
| A.91.6% | B.8.4% | C.83.2% | D.88.2% |
某无色溶液中,已知含有H+、Mg2+、Al3+等阳离子,加入NaOH溶液的体积(v)和生成沉淀的质量(m)之间的关系如下图所示,其中正确的是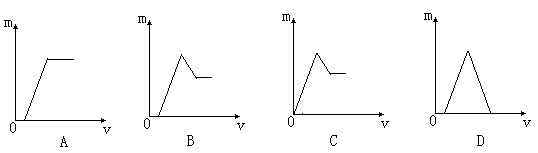
一定条件下,下列说法正确的是
| A.常温时,把pH=1的醋酸溶液稀释10倍后,其pH=2 |
| B.常温时,向CaCO3的饱和溶液中加入Na2CO3固体,则CaCO3的溶度积常数增大 |
| C.向氨水中加入氯化铵固体,会使溶液的pH减小 |
| D.稀释Na2CO3溶液,溶液中c(OH—)增大 |