0.6mol/L的Fe2(SO4)3和1.2mol/L的CuSO4的混合溶液200mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+物质的量之比为2:1,则加入铁粉的物质的量为
| A.0.16 mol | B.0.22mol | C.0.30mol | D.0.48mol |
Se是人体必需微量元素,下列关于 和
和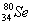 的说法正确的是()
的说法正确的是()
A. 和 和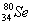 互为同位素 互为同位素 |
B. 和 和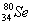 都含有34个中子 都含有34个中子 |
C. 和 和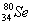 分别含有44和46个质子 分别含有44和46个质子 |
D. 和 和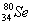 含有不同的电子数 含有不同的电子数 |
雷雨天闪电时空气中有臭氧(O3)生成。下列说法正确的是()
| A.O2和O3互为同位素 |
| B.O2和O3的相互转化是物理变化 |
| C.在相同的温度与压强下,等体积的O2和O3含有相同的分子数 |
| D.等物质的量的O2和O3含有相同的质子数 |
下列物质中,只含有非极性共价键的是()
| A.NaOH | B.NaCl | C.H2 | D.H2S |
元素的性质呈现周期性变化的决定性因素是()
| A.元素原子半径大小呈现周期性变化 |
| B.元素原子量依次递增 |
| C.元素原子的核外电子排布呈现周期性变化 |
| D.元素的最高正化合价呈现周期性变化 |
元素的种类与原子的种类()
| A.前者大 | B.相同 | C.后者大 | D.无法确定 |