已知电离平衡常数:H2CO3>HClO>HCO3-,下列有关叙述中,正确的是
①若KI溶液中混有Br-,加入足量FeCl3溶液,用CCl4萃取后,取无色的水层并加入AgNO3溶液,有淡黄色沉淀生成。
②向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-
③向NaClO溶液中通入少量二氧化碳的离子反应方程式:2ClO-+CO2+H2O===2HClO+CO32—
④海水提溴过程中,用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为
3Br2+6CO32-+3H2O=5Br-+ BrO3-+6HCO3-
| A.②④ | B.①③ | C.②③ | D.①④ |
从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4下列说法正确的是
| A.Cu2S既是氧化产物又是还原产物 |
| B.5 mol FeS2发生反应,有10 mol电子转移 |
C.产物中的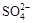 离子有一部分是氧化产物 离子有一部分是氧化产物 |
| D.FeS2只作还原剂 |
由CO2、H2和CO组成的混合气体,在同温同压下与N2的密度相同,则该混合气体中CO2、H2和CO的体积比为
| A.29:8:13 | B.22:1:14 | C.13:8:29 | D.26:6:57 |
标准状况下,在四个干燥的烧瓶中分别充入:①纯净的氨气;②混有1/3体积空气的氯化氢气体;③纯净的NO2气体;④混有少量O2的NO2气体。然后各做喷泉实验。实验后,三烧瓶中溶液的物质的量浓度大小关系是( )
| A.①=②=③=④ | B.①=②=③>④ | C.①=②=③<④ | D.④>①=②>③ |
分析下表中各项的排布规律。有机物X是按此规律排布的第19项,下列有关X的组成、性质的说法中肯定错误的是( )
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| CH4 |
CH2O |
CH2O2 |
CH4O |
C2H6 |
C2H4O |
C2H4O2 |
C2H6O |
①是戊酸 ②是戊醇 ③是丁酸甲酯 ④在稀硫酸中易变质 ⑤一定能与钠反应
A.②⑤ B.①③④ C.③④ D.②③⑤
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如右图。下列叙述正确的是()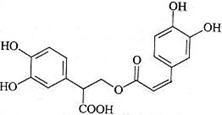
| A.迷迭香酸属于芳香烃 |
| B.1mol迷迭香酸最多能和9mol氢气发生加成反应 |
| C.迷迭香酸可以发生水解反应、取代反应和酯化反应 |
| D.1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应 |