下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
| A.取a克混合物充分加热,减重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。 |
下列实验的现象及结论不正确的是
| A.过氧化钠放置在空气中,最终转变为白色粉末Na2CO3 |
| B.SO2通入BaCl2溶液中产生白色沉淀BaSO3 |
| C.打磨过的铝箔和未打磨的铝箔分别在空气中灼烧,两种铝箔均熔化但不滴落,说明氧化铝熔点比铝高 |
| D.分别向等物质的量浓度的Na2CO3和NaHCO3溶液中滴加酚酞,溶液都变红,Na2CO3溶液红色较深,说明Na2CO3水解程度大于NaHCO3 |
短周期元素X、Y、Z在周期表中所处的位置如图所示,三种元素的原子质子数之和为32,下列说法正确的是
| X |
Z |
|
| Y |
A.三种元素中,Z元素的最高价氧化物对应的水化物的酸性最强
B.X、Z两种元素的气态氢化物相互反应的产物是共价化合物
C.三种元素对应的气态氢化物中,Z元素形成的氢化物最稳定
D.Y元素的气态氢化物与Y的最高价氧化物对应的水化物不可能发生反应
下列说法正确的是
| A.丁烷的沸点高于丙醇 |
B.聚丙烯的结构简式为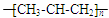 |
C.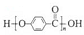 由苯酚和甲酸缩聚而成 由苯酚和甲酸缩聚而成 |
| D.可用新制的Cu(OH)2鉴别乙醛、乙酸、乙醇 |
下列解释物质用途的反应方程式不正确的是
A.用Fe2(SO4)3净水 Fe3+ + 3H2O Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ |
B.用Na2S处理含Hg2+废水 Hg2+ + S2- HgS↓ HgS↓ |
C.用Na2CO3溶液处理水垢中的CaSO4 Ca2+ + CO32-  CaCO3↓ CaCO3↓ |
D.燃煤时加入石灰石,减少SO2排放 2CaCO3 + 2SO2 + O2 2CaSO4 + 2CO2 2CaSO4 + 2CO2 |
25℃时,下列溶液中水的电离程度最小的是
| A.0.01 mol/L盐酸 | B.0.01 mol/L Na2CO3溶液 |
| C.pH =" 4" NaHSO3溶液 | D.pH =11氨水 |