氯水中存在多种分子和离子, 它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是
| A.加入有色布条, 一会儿有色布条退色, 说明有Cl2存在 |
| B.溶液呈黄绿色, 且有刺激性气味, 说明有 Cl2分子存在 |
| C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在 |
| D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O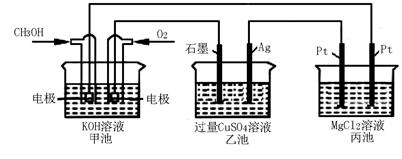
则下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一段时间,向乙池加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
化合物X、Y、Z之间有如图所示的转化关系。下列说法中不正确的是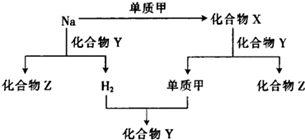
| A.图中的每一步反应都是氧化还原反应 |
| B.钠与Y物质的反应是离子反应 |
| C.X与Y的反应中,氧化剂是X,还原剂是Y |
| D.Z是离子化合物 |
已知链式炔碳C300经过适当处理可得含多个―C≡C―(不含 )的链状化合物C300H298,则该分子中含―C≡C―的个数为
)的链状化合物C300H298,则该分子中含―C≡C―的个数为
| A.70 | B.72 | C.74 | D.76 |
下列说法中正确的是
| A.含有碳碳双键的有机物均有顺反异构 |
| B.乙烯和聚乙烯均能使酸性KMnO4溶液褪色 |
| C.利用电石与水反应制取C2H2时,可采用CuSO4溶液除去杂质气体 |
| D.苯酚与甲醇在酸性条件下聚合生成酚醛树脂 |
化学与科学、技术、社会、环境密切相关,下列说法中正确的是
| A.绿色化学的核心是应用化学原理对环境污染进行治理 |
| B.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| C.泄露在美国墨西哥湾海洋中的大量原油能被海洋生物迅速分解,不会导致生态灾难 |
| D.电镀废液中含浓度较高的含氮化合物,经中和后可直接用于浇灌农作物 |