1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(折算到标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是2:1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2 CO2+H2O。下列有关说法正确的是
CO2+H2O。下列有关说法正确的是
| A.该反应为吸热反应 | B.CO2分子是由极性键形成的极性分子 |
| C.HCHO分子中既含σ键又含π键 | D.每生成1.8gH2O消耗2.24L O2 |
下列叙述正确的是
| A.在晶体硅中,Si原子与Si—Si键数目比为1:2 |
| B.分子晶体中都存在范德华力,分子内都存在共价键 |
| C.HF、HCl、HBr、HI四种物质的沸点依次升高 |
| D.干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
已知N≡N键的键能是a kJ﹒mol-1,H-H键的键能是b kJ﹒mol-1,N-H键的键能是c kJ﹒mol-1,则N2(g) + 3 H2(g) =" 2" NH3(g)的△H(单位:kJ﹒mol-1)为
| A.3c–a-b | B.a+b-3c | C.a+3b-2c | D.a+3b-6c |
下列元素的电负性最大的是
| A.Na | B.O | C.S | D.C |
下列表达式错误的是
A.甲基的电子式: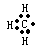 |
B.碳原子的外围电子轨道表示式: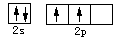 |
| C.硫离子的核外电子排布式:1s22s22p6 |
| D.碳-14原子:14 6C |