某溶液中含有NH4+、Fe2+、Fe3+、Al3+四种离子,若向溶液中先滴加过量的NaOH溶液,然后再滴加过量的稀盐酸,则溶液中离子数目保持不变的是:
| A.Al3+ | B.NH4+ | C.Fe3+ | D.Fe2+ |
现代建筑的门窗框架常用电解加工成的古铜色硬铝制造。取硬铝样品进行如下所示的实验(各步试剂均过量)。
由此可推知,硬铝的组成可能为( )
| A.Al、Fe、Cu、C | B.Al、Mg、Si、Zn |
| C.Al、Cu、Mg、Si、Mn | D.Al、Si、Zn、Na、Mg |
Mg、Al两种金属分别跟同体积、同浓度的稀H2SO4反应,同温同压下生成氢气的体积相同,则Mg、Al两种金属之间的量的关系一定正确的是( )
| A.两个反应电子转移的数目相等 |
| B.加入镁、铝质量比为4∶3 |
| C.金属溶解的物质的量相等 |
| D.加入的两种金属质量不等 |
某二价金属m g,与足量的盐酸反应后,在标准状况下生成V L H2。则该金属的相对原子质量是( )
A.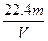 |
B. |
C.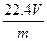 |
D.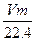 |
0.1 mol某元素的单质,直接与氯气反应后,质量增加7.1 g。据此可知该元素是( )
| A.磷 | B.铁 |
| C.钾 | D.镁 |
现有200 mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)="0.2" mol·L-1,c(Cl-)="1.3" mol·L-1,要使Mg2+转化为Mg(OH)2,并使Mg2+与Al3+分离开,至少需要4 mol·L-1的NaOH溶液的体积为( )
| A.140 mL | B.120 mL |
| C.100 mL | D.80 mL |