某混合液中可能含有下列离子中的若干种:K+、Na+、 Fe2+、Fe3+、SO42―、HCO3―、CO32―。现取三份20 mL该溶液进行如下实验:
① 第一份加入足量稀盐酸,无任何气体产生;
② 第二份加入足量NaOH,经搅拌,过滤,洗涤,灼烧,最后得到x g固体;
③ 第三份滴加0.1 mol·L―1酸性KMnO4溶液,反应至终点,共消耗其体积为V mL;
④ 另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色。
根据上述实验,以下说法正确的是:
| A.由实验①无法推断原混合溶液中是否含有SO42― |
| B.原混合溶液中只存在Na+、 Fe3+、SO42―,不可能存在K+、CO32― |
| C.由实验①、②可判断原混合液中是否含Fe3+ |
| D.由实验③可判断原混合液中存在Fe2+ |
若把元素所处的族分为主族、副族、Ⅷ族和0族四类,下列数字分别为元素原子的次外层和最外层上的电子数,其中可以肯定为副族元素的是()
| A.18,1 | B.8,2 | C.18,3 | D.18,8 |
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是()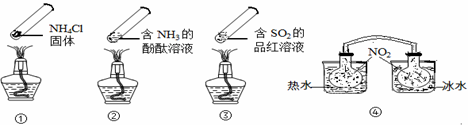
| A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,②、③溶液均变红,冷却后又都变为无色 |
| C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
| D.四个“封管实验”中所发生的化学反应都是可逆反应 |
下列说法不正确的是
| A.化学反应有新物质生成,并遵循质量守恒定律和能量守恒定律 |
| B.原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物的官能团 |
| C.分子间作用力比化学键弱得多,但它对物质熔点、沸点有较大影响,而对溶解度无影响 |
| D.酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义 |
实验室制取下列气体时,与实验室取氨气的气体发生装置相同的是
| A.CO2 | B.H2 | C.Cl2 | D.O2 |
在盐类水解的过程中,下列说法正确的是
| A.盐的电离平衡被破坏 | B.水的电离程度一定会增大 |
| C.溶液的pH一定会增大 | D.(H+)与c(OH-)的乘积一定会增大 |