如图进行实验,试管中现象对应的离子方程式不正确的是
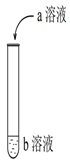
| 选项 |
a |
b |
试管中现象 |
离子方程式 |
| A |
硫酸 |
KI淀粉 |
在空气中放置一段时间后溶液呈蓝色 |
4H++ 4I- + O2=2I2 + 2H2O |
| B |
稀盐酸 |
Na2CO3 |
开始时无气泡,后来有气泡 |
CO + H+ = HCO + H+ = HCO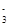 ; ;HCO 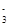 + H+ =H2O + CO2↑ + H+ =H2O + CO2↑ |
| C |
稀盐酸 |
Na2SiO3 |
产生白色胶状物 |
2H++ SiO =H2SiO3(胶体) =H2SiO3(胶体) |
| D |
硫酸 |
滴有酚酞Ba(OH)2 |
有白色沉淀生成,溶液由红色变为无色 |
Ba2+ + OH- + H+ + SO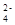 = =BaSO4↓ + H2O |