下列有关说法中错误的是
| A.某燃料电池用熔融碳酸盐作电解质,两极分别通入CO和O2,则通入CO的一极为负极,电极反应式为CO-2e-+CO32-=2CO2 |
| B.Zn粒与稀硫酸反应制氢气时,为加快反应速率,可在反应过程中滴加几滴CuSO4溶液 |
| C.根据自发氧化还原反应Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O设计原电池,可在常温下用铜和铁作电极,使用浓硝酸作电解质溶液 |
| D.原电池中电子从负极出发,经外电路流向正极,再从正极经电解液回到负极构成闭合回路 |
如下图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深。下列说法中错误的是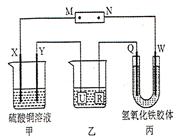
| A.电源的M 极为正极 |
| B.甲装置中溶液的pH 减小 |
| C.甲装置的两个电极上都有单质生成且物质的量之比为1︰1 |
| D.欲用乙装置给铜镀银,U极应该是Ag,电镀液选择AgNO3 |
溶液
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
目前人们正研究开发一种高能电池—钠硫电池,它是以熔融的钠、硫为两极,以导电的β—Al2O3陶瓷作固体电解质,反应为:2Na+xS Na2Sx,以下说法错误的是
Na2Sx,以下说法错误的是
| A.放电时,钠作负极,硫作正极 |
| B.若此电池用作电源电解饱和NaCl溶液,当阳极产生11.2L(标况)气体时,消耗金属钠23g |
| C.充电时,钠极与外电源的正极相连,硫极与外电源的负极相连 |
| D.充电时,阳极发生的反应是:Sx2--2e=xS |
下图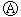 为直流电源,
为直流电源,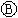 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,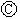 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现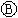 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.
后,使c、d两点短路.
下列叙述错误的是
| A.a为直流电源的正极 |
| B.c极发生的反应为2H++2e-=H2↑ |
| C.f电极为锌板 |
| D.e极发生氧化反应 |
下图装置为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为:2K2S2+KI3 K2S4+3KI。装置(Ⅱ)为电解池的示意图。当闭合开关K时,X附近溶液先变红。则下列说法正确的是
K2S4+3KI。装置(Ⅱ)为电解池的示意图。当闭合开关K时,X附近溶液先变红。则下列说法正确的是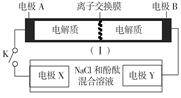
| A.闭合K时,K+从右到左通过离子交换膜 |
| B.闭合K时,A的电极反应式为:3I--2e-=I |
| C.闭合K时,X的电极反应式为:2Cl--2e-=Cl2↑(Ⅱ) |
| D.闭合K时,当有0.1 mol K+通过离子交换膜,X电极上产生标准状况下气体1.12 L |