某同学设计了测定空气中氧气含量的实验,实验装置如图。
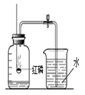
(1)该实验中红磷需过量,目的是 。
(2)燃烧结束并冷却,打开止水夹后观察到的现象是 ,从上述实验现象也可知氮气的有关性质,指出两点即可:①__ ___(化学性质).②__ ____(物理性质).
(3)该同学认为红磷既不能换成木炭也不能换成铁丝,请你帮他说明原因?
下图是过氧化氢在一定条件下发生分解反应的微观模拟图,请回答下列问题:
(1)在C图中将相关粒子图形补充完整(用 表示氢原子,用
表示氢原子,用 表示氧原子);
表示氧原子);
(2)此化学变化中没有发生改变的粒子是(填名称);
(3)此反应后生成的B与C中物质质量的最简整数比为。
汽车方便了人们的出行,氢能源汽车备受人们关注。
(1)目前,多数汽车使用的燃料是汽油或柴油。为减少汽车尾气对空气的污染,可采取使用(或安装)_装置使有害气体转化为无害物质等措施;
(2)氢能源汽车在行驶过程中的能量转化是从能开始,最终转化为能。氢能源有本身无毒、原料来源广、可再生、等优点(填一点)。
(3)某些汽车轮胎是由合成材料和金属材料复合而成。
其中使用的合成材料,主要利用它的等性能(填字母)。
| A. |
耐高温、高弹性 |
B. |
透气性好、耐磨 |
C. |
密度小、熔点低 |
其中使用的金属材料一般为铁合金,主要利用它的等性能(填字母)。
| A. |
导热性好 |
B. |
绝缘性好 |
C. |
硬度大 |
黑龙江绿色食品闻名全国,近几年推出的蓝莓系列产品因其天然 健康的品质,深受大家的喜爱。
(1)制作蓝莓饮料需要蓝莓果。蓝莓果等水果是人体获取(填除水外的一种营养素)的主要来源之一,该营养素可以起到调节、预防疾病和维持身体健康的作用。
(2)蓝莓酒中含有酒精等成分,酒精的化学式为。酒精还可通过玉米等发酵、蒸馏而制得。为了使玉米增产增收,在种植过程中有时需施加适量磷肥。磷肥能增强作物的、能力。磷矿粉是常用的磷肥之一,其主要成分的化学式为。
实验室常用下列装置来制取氧气:
(1)写出编号为①的仪器名称;
(2)用过氧化氢溶液和二氧化锰来制取氧气时,应选用的发生装置是(填"甲"或"乙");若用丙装置除去氧气中的水蒸气,丙中盛放的液体试剂是,气体应从(填"
"或"
")端导入。
海南省是全国海洋面积最大的省份,南海蕴含丰富的化石燃料和矿产资源。
(1)请写出你知道的一种化石燃料。
(2)请你写出一条保护金属资源的措施。(2 分)