下列离子方程式书写及评价合理的是
| |
离子方程式 |
评价 |
| A |
Mg(HCO3)2溶液中加入足量的NaOH溶液Mg2++2HCO3-+2OH-=MgCO3↓+ CO32-+ 2H2O |
正确,NaOH过量,酸式盐与碱完全反应生成正盐和水; |
| B |
1mol/L的NaAlO2溶液与2.5mol/L的HCl溶液等体积混合2AlO2-+5H+ =Al3+ +Al(OH)3↓+H2O |
正确,AlO2-与H+按物质的量1:1反应转化为Al(OH)3,过量的H+再将一半Al(OH)3转化为Al3+ |
| C |
将少量的Fe3O4溶解在过量的稀HNO3中Fe3O4+8 H+= Fe2+ + 2Fe3+ + 4H2O |
正确,Fe3O4化学式可改写为FeO·Fe2O3,Fe2+与Fe3+物质的量之比为1:2 |
| D |
将FeCl2溶液加入到NaClO溶液中 Fe2+ +2ClO-+2H2O = Fe(OH)2↓+2HClO |
错误,Fe2+与ClO-会发生氧化还原反应: 2Fe2+ +ClO-+5H2O =2Fe(OH)3↓+ Cl-+4H+ |
下列各组溶液中,只用括号内的试剂及物质间相互反应无法鉴别的一组是()
| A.Ba(OH)2、KSCN、NaCl、K2SO4(FeCl3溶液) |
| B.NaNO3、NaHCO3、Na2SO3、Na2SiO3(H2SO4溶液) |
| C.NaBr、Na2CO3、KI、CaCl2(AgNO3溶液) |
| D.NH4Cl、Mg(NO3)2、CuSO4、AlCl3(KOH溶液) |
关于下列说法:①Fe(OH)3胶体和CuSO4溶液都是混合物;②BaSO4是一种难溶于水的强电解质;③冰醋酸、纯碱、小苏打分别属于酸、碱、盐;④太阳能、氢能和海洋能都属于新能源;⑤置换反应都属于离子反应。其中正确的是()
| A.①②④ | B.①②⑤ | C.②③④ | D.③④⑤ |
下列说法或表达正确的是()
①次氯酸的电子式为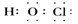
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④丁达尔效应可用于区别溶液和胶体,云、雾均能产生丁达尔效应
⑤C、P、S、Cl的氧化物对应水化物的酸性逐渐增强
A.①③⑤ B.①②④ C.①②③ D.②④⑤
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
下列说法正确的是
| A.气体A是NO2 | B.X中肯定存在Fe2+、A13+、NH4+、SO42― |
| C.溶液E和气体F不能发生化学反应 | D.X中不能确定的离子是A13+和C1― |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
FeCl3+H2S=FeCl2+S;PbO2+4HCl=PbCl2+Cl2↑+2H2O
2Fe(OH)2+Cl2+2KOH=2Fe(OH)3+2KCl;Cl2+2KOH=KCl+KClO+H2O
水溶液中的复分解反应:(Se元素的原子序数为34)
CuSO4+H2S=CuS↓+H2SO4;H2SeO4+2NaN3=Na2SeO4+2HN3;HN3+Na2S=NaN3+H2S
热分解反应:
BaCO3 BaO+CO2↑;MgCO3
BaO+CO2↑;MgCO3 MgO+ CO2↑;CuCO3
MgO+ CO2↑;CuCO3 CuO+ CO2↑
CuO+ CO2↑
下列说法不正确的是
| A.氧化性(酸性溶液):PbO2>Fe3+>S |
| B.还原性(碱性溶液):Fe(OH)2>KCl>Cl2 |
| C.酸性(水溶液):H2S>H2SO4>H2SeO4>HN3 |
| D.热稳定性:CaCO3>FeCO3>Ag2CO3 |