【化学选修3:物质结构与性质】
(1)美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型。多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是 。
A、NO2-和NH4+ B、H3O+和ClO3- C、NO3-和CO32- D、PO43-和SO42-
(2)铜、锌两种元素的第一电离能、第二电离能如表所示
| 电离能/kJ·mol-1 |
I1 |
I2 |
| 铜 |
746 |
1958 |
| 锌 |
906 |
1733 |
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是 。
(3)石墨烯是从石墨材料中剥离出来、由碳原子组成的只有一层原子厚度的二维晶体。其结构如图:
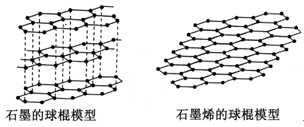
有关说法正确的是
A、固态时,碳的各种单质的晶体类型相同 B、石墨烯中含有非极性共价键
C、从石墨中剥离石墨烯需要破坏化学键 D、石墨烯具有导电性
(4)最近科学家成功以CO2为原料制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以4个共价单键与氧原子结合为一种空间网状的无限延伸结构,则该晶体中碳原子采用 杂化与周围氧原子成键;晶体中碳氧原子个数比为 ;碳原子数与C-O化学键数之比为 。
(5)已知钼(Mo)的晶胞为体心立方晶胞,钼原子半径为a pm,相对原子质量为M,以NA表示阿伏伽德罗常数的值,请写出金属钼密度的计算表达式 g/cm3。
有X、Y、Z三种元素,已知X、Y是元素周期表前20号元素,且X的原子序数比Y大4,元素Z形成的金属单质在日常生活中应用最广泛。请回答:
Ⅰ.若X是短周期最活泼的金属元素。
(1)写出Y的单质的结构式。
(2)写出单质Z与元素Y的最高价氧化物对应的水化物(稀溶液,过量)反应的离子方程式。
Ⅱ.若X的简单离子半径是第三周期元素简单离子半径最小的。
(3)在定向爆破中,常利用氧化铁和单质X反应放出的热量来切割钢筋。该反应的化学方程式为。
(4)已知X的阳极氧化是一种常用的金属表面处理技术,它能使X的表面形成致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中模拟该处理过程,装置如图所示,该阳极的电极反应式为。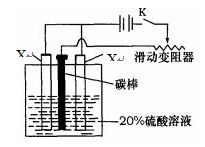
Ⅲ.含Z的化合物A(化学式为K2ZO4)极易溶于水,但静置一段时间后转化为红褐色沉淀,同时产生O2。
(5)化合物A溶于水后的变化(用离子方程式表示)。查阅资料发现,加入下列物质中的可提高A在水中的稳定性。
| A.Na2CO3 | B.KSCN | C.NH4NO3 | D.KOH |
以钛酸亚铁(FeTiO3)为原料制取BaTiO3的过程如下图所示:
(1)FeTiO3与稀硫酸反应,产物有TiOSO4、H2O和(填化学式)。
(2)已知:TiO2(s)+H2SO4(aq)=TiOSO4(aq)+H2O (l) △H=akJ·mol-1
H2TiO3(s)=TiO2(s)+H2O (l) △H=b kJ·mol-1
写出TiOSO4水解生成H2TiO3的热化学方程式。
(3)写出TiO2生成BaTiO3的化学方程式。
4种短周期元素相对位置如下表。M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。回答下列问题:
(1)X的原子结构示意图为。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是。
(3)Y的氧化物与NaOH溶液反应的化学方程式是。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR溶液中,c(H+)=1.3×10-3 mol·L-1。则HR H++R-的电离平衡常数Ka=(保留一位小数)。
H++R-的电离平衡常数Ka=(保留一位小数)。
用如图所示装置做“铜与浓硝酸反应”的实验。
(1)从试剂瓶中取出一小块铜片放入试管中,需用的仪器是。
(2)棉花应蘸溶液(填化学式)。
(3)试管中除了溶液变成绿色外,还会出现的现象是(填序号)。
A.有红棕色气体生成,上下颜色相同
B.有红棕色气体生成,上部颜色较浅
C.有红棕色气体生成,下部颜色较浅
(4)实验结束后,对试管内残留物的处理方法是。
向含2 mol H2SO4和1 mol HNO3的混合稀溶液中加入过量的锌,假设HNO3被还原的产物全部为NO。
①写出反应的离子方程式。
②生成的气体在标况下的体积为:。