常温下,下列各组离子在指定溶液中能大量共存的是
| A.通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- |
| B.饱和氯水中:Cl-、NO3-、Na+、SO32- |
| C.c(H+)=1×10-1 mol•L-1的溶液中:Cu2+、Al3+、SO42-、NO3- |
| D.0.1 mol·L-1 CH3COONa溶液:H+、Al3+、Cl-、NO3- |
A+、B+、C-、D-四种离子两两组成四种可溶性盐,其中AC和BD的盐溶液的pH=7,BC盐溶液pH>7,则下列说法正确的是:
A、AD盐溶液pH>7
B、酸的电离程度一定是HD<HC
C、碱的电离程度一定是AOH>BOH
D、在AC盐溶液中c(A+)+ c(AOH)= c(C-)+ c(HC)
由一种阳离子和两种酸根离子组成的盐称混盐。下列关于混盐Na4S2O3的有关判断,不正确的是
| A.该混盐水溶液呈碱性 |
| B.该混盐与H2SO4反应有气体生成 |
| C.该混盐溶液加入BaCl2可以生成白色沉淀 |
| D.该混盐在酸性条件下可生成S,每产生32g S转移2NA个电子 |
已知某有机物X的结构简式如图所示,下列有关叙述不正确的是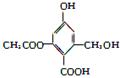
| A.X的化学式为C10H10O6 |
| B.X在一定条件下能与FeCl3溶液发生显色反应 |
| C.1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、4 mol、1 mol |
| D.X在一定条件下能发生消去反应和酯化反应 |
下列说法正确的是
| A.电解法精炼铜,当阴极质量增加32 g时,一定有6.02×1023个电子转移 |
| B.含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022 |
| C.28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子 |
| D.含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022 |
下列解释实验事实的方程式正确的是
| A.Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3+ + 3OH-= Al(OH)3 ↓ |
B.90℃时测得纯水中c(H+)·c(OH-) =3.8×10-13:H2O(l) H+(aq) + OH-(aq) △H<0 H+(aq) + OH-(aq) △H<0 |
| C.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2 +2H2O = 2Fe2+ + SO42-+ 4H+ |
D.碳酸钠溶液滴入酚酞变红:CO32-+ 2H2O  H2CO3 + 2OH- H2CO3 + 2OH- |