进行化学实验,观察实验现象,通过分析推理得以正确的结论是化学学习的方法之一。下列说法正确的是
| A.浓硝酸在光照条件下变黄,说明浓硝酸不稳定生成的有色产物能溶于浓硝酸 |
| B.在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 |
C.氯化钠溶于水发生电离,电离方程式为:NaCl Na+ + Cl¯,说明NaCl在通电条件下发生电离。 Na+ + Cl¯,说明NaCl在通电条件下发生电离。 |
| D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是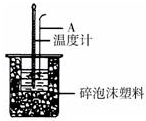
| A.稍过量的氢氧化钠是确保盐酸完全反应 |
| B.仪器A的名称是环形玻璃搅拌棒 |
| C.在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H偏大 |
| D.用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的 |
向足量H2SO4溶液中加入100mL 0.4mol·L﹣1 Ba(OH)2溶液,放出的热量是5.12kJ.如果向足量Ba(OH)2溶液中加入100mL 0.4mol·L﹣1盐酸时,放出的热量为2.2 kJ.则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
| A.Ba2+(aq)+SO42﹣(aq)═BaSO4(s) △H=﹣2.92 kJ·mol﹣1 |
| B.Ba2+(aq)+SO42﹣(aq)═BaSO4(s) △H=﹣18 kJ·mol﹣1 |
| C.Ba2+(aq)+SO42﹣(aq)═BaSO4(s) △H=﹣73 kJ·mol﹣1 |
| D.Ba2+(aq)+SO42﹣(aq)═BaSO4(s) △H=﹣0.72 kJ·mol﹣1 |
化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,下列叙述中正确的是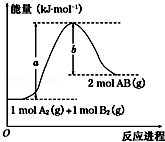
| A.每生成2个分子AB吸收(a﹣b) kJ热量 |
| B.该反应热△H=+(a﹣b)kJ·mol﹣1 |
| C.该反应中反应物的总能量高于生成物的总能量 |
| D.断裂1mol A﹣A和1mol B﹣B键,放出a kJ能量 |
对于达到平衡的反应:2A(g)+B(g)⇌nC(g),符合如图所示的结论是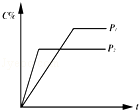
| A.P1>P2,n>3 | B.P1>P2,n<3 | C.P1<P2,n>3 | D.P1<P2,n<3 |
利用反应:2NO(g)+2CO(g)⇌2C02(g)+N2(g)△H=﹣746.8kJ•mol﹣1,可净化汽车尾气,如果要同时提高反应的速率和N0的转化率,采取的措施是
| A.降低温度 |
| B.增大压强 |
| C.升高温度同时充入N2 |
| D.及时将C02和N2从反应体系中移走 |