某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液200 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
| A.至少存在5种离子 |
| B.Cl-一定存在,且c(Cl-) ≥0.2mol/L |
| C.SO42-、NH4+、Fe3+一定存在,Cl-可能不存在 |
| D.CO32-、Al3+一定不存在,K+可能存在 |
关于氯化铁水解的错误说法是
| A.水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动 |
| B.浓度为5mol/L和0.5mol/L的两种FeCl3溶液,其它条件相同时,Fe3+的水解程度前者比后者低 |
| C.有50℃和20℃的相同浓度氯化铁溶液,其他条件相同时,Fe3+的水解程度前者比后者小 |
| D.为抑制Fe3+水解,较好地保存FeCl3溶液,应加少量盐酸 |
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是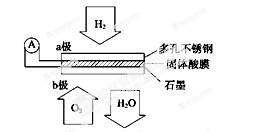
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为O2+2H2O+4e-===4OH- |
| C.每转移0.2 mol电子,消耗标准状况下1.12 L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |
常温下,下列叙述错误的是
A.向0.1mol·L-1的醋酸溶液中加水或通入HCl气体都能使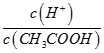 值增大 值增大 |
B.0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后溶液显酸性,则有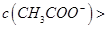 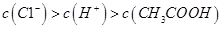 |
C.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液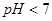 |
D.0.1mol·L-1某一元酸HA溶液中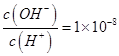 ,则该溶液中由水电离出的 ,则该溶液中由水电离出的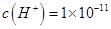 mol·L-1 mol·L-1 |
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是
| A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 |
| B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 |
| C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
25℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,不正确的是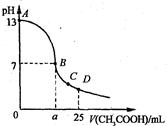
A、C点时c(CH3COO-)>c(Na+)>c(H+)>c(OH—)
B、D点时c(CH3COO-)+c(CH3COOH)=2c(Na+)
C、曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COOˉ)>c(OH-)>c(H+)
D、B点的横坐标a=12.5ml