(1)用14.2g无水硫酸钠配制成250mL溶液,其物质的量的浓度为 mol/L。
①若从中取出10mL,其物质的量的浓度为 mol/L。
②若将这10mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为 mol/L。若将稀释后的100mL溶液中的SO42-全部沉淀下来,至少需要加入0.1 mol/L的BaCl2溶液 mL。
(2)400mL0.8mol/LH2SO4溶液(ρ=1.08g/cm3)和200mL98%浓硫酸(ρ=1.84g/cm3)混合,所得H2SO4稀溶液的密度为1.2g/cm3,则混合后稀H2SO4的物质的量的浓度为 mol/L。
(12分)一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:3A(g)+B (g) xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。
①1min内,B的平均反应速率为_________;x_________;
②若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”);
③平衡混合物中,C的体积分数为22%,则A的转化率是_________;
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的关系式_________。
(2)若维持容器压强不变
①达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________molA气体和_________molB气体
现用氯气与氢氧化钠溶液反应,若耗用的氯气为4.48L (标准状况)。
(1)则选用所贴标签为2.0mol·L-1的氢氧化钠,至少需该氢氧化钠多少毫升?
(2)如选用所贴标签为7%(密度为1.043g·mL-1)的盐酸中和上述反应中所消耗的氢氧化钠,至少需该盐酸多少毫升?
已知某种燃料含有碳、氢、氧3种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收)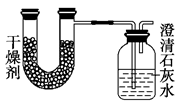
| 实验前 |
实验后 |
|
| (干燥剂+U形管)的质量 |
101.1 g |
102.9 g |
| (石灰水+广口瓶)的质量 |
312.0 g |
314.2 g |
根据实验数据求:
(1)实验完毕后,生成物中水质量为________g,假设广口瓶里生成一种正盐,其质量为________g;
(2)生成的水中氢元素的质量为________g;
(3)生成的二氧化碳中碳元素的质量为________g;
(4)该燃料中碳元素与氢元素的质量比为________;
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________。
(1)乙烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,其中,与高锰酸钾发生的反应是________反应(填反应类型,下同);与溴发生的反应是________反应。在一定的条件下,乙烯还能发生________反应,生成聚乙烯。
(2)一种能使溴水褪色的气态烃,标准状况下5.6 L的质量为10.5 g,10.5 g该烃完全燃烧时生成16 .8 L二氧化碳和13.5 g水。则该烃的分子式为________。
(13分)通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是______________;
(2)X与金属钠反应放出氢气,反应的化学方程式是_____________________________
(有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是____________;
(4)X与高锰酸钾酸性溶液反应可生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应能生成106 g W,计算该反应的产率。(要求写出计算过程)