(共12分)各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板。请回答下列问题:

(1)G元素在周期表中的位置______________。
(2)写出实验室制备G的离子反应方程式 。
(3)气体D与NaOH溶液反应可生成两种盐P和Q,在P中Na的质量分数为43%,其俗名为 。
(4)实验室中检验L溶液中的阳离子常选用 溶液,现象是 。
(5)A中包含X、Y、Z元素,A的化学式为 。
)某种液态有机化合物的分子式为C3H8O,为确定其分子结构进行如下探索过程,请填空:
(1)写出满足C3H8O的所有分子的结构简式(标明序号)
______________________________________________________________________。
(2)向该有机化合物中加入金属钠后有气体产生。取6.0 g该物质于反应器中,加入足量的金属钠充分反应后,经测量产生的气体在标准状况下约1.12 L。
① 写出满足上述条件的所有分子的结构简式___________________________________。
②又经测得该物质能与O2在铜作催化剂时加热可以反应生成醛(含-CHO),则该有机化合物的结构简式为:_________________。以上过程的反应方程式为:_____________。
已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去)。其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取。D为烃,不能使酸性高锰酸钾溶液褪色。E、G为生活中常见的有机物,且E有特殊香味,H有香味。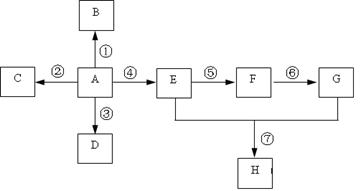
(1)写出下列各物质的官能团的名称:
A ___________;F ___________;G___________。
(2)按要求写出下列各步变化的化学方程式(注明反应条件)
反应①_____________________________________________________;
反应④_____________________________________________________;
反应⑦ _____________________________________________________。
(3)写出下列反应类型:
反应① ___________,反应②___________,反应④___________,反应⑦___________。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出气体丙的电子式
(2)写出反应①的化学方程式
反应③的离子方程式:
反应⑤的离子方程式:
(3)若在F溶液中加入D溶液,并露置于空气中,能观察到的现象是。
某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色沉淀,I为红褐色沉淀。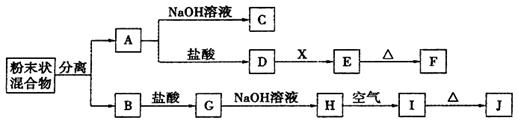
(此转化关系中所用的试剂都是足量的)
(1)写出下列物质的化学式:F,G。
(2)D→E的转化中,加入过量的X可能是。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(3)写出下列转化的化学方程式:
A→C:;
H→I:。
某有机物B是芳香烃的含氧衍生物,其相对分子质量不超过120,B中含氧的质量分数为14.8%,B与NaOH溶液不发生反应。有机物A在一定条件下可发生反应A+H2O B+C。有关C的转化关系如下图所示:
B+C。有关C的转化关系如下图所示:
已知: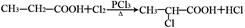
根据以上信息,回答下列问题:
(1)B的结构简式为,条件I、II中均需要的试剂为。
(2)有关C的转化关系图中所发生的反应中属于取代反应的有个。
(3)C的同分异构体中,同时符合下列要求的物质有种。
a.苯环上有两个侧链 b.能发生银镜反应 c.能发生消去反应
(4)写出下列转化的化学方程式
F→E;
F→G