过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2)。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
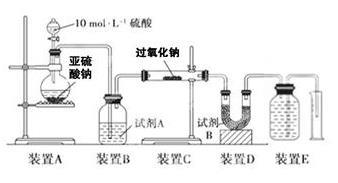
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:
假设1:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化;
假设3: ,证明 。
实验探究:
实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:
(2)试剂A可以选用____________________,试剂B的作用是________________________。
(3)实验测得装置C中过氧化钠质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据判断SO2未被氧化、完全被氧化的V-m1关系式。
未被氧化:____________________,完全被氧化:_______________________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________。
实验室制配0.4mol/L的NaCl溶液100 mL,有以下仪器:①烧杯 ②100 mL量筒 ③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦药匙
(1)配制时,还缺少的仪器是____________。
(2)应称取的NaCl固体的质量是____________克。
(3)实验两次用到玻璃棒,其作用分别是:
_____________、____________。
⑷配制时,一般过得程是:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥洗涤 ⑦摇匀 ⑧定容 ⑨摇匀。其中最后一次摇匀的方法是_____________(a、左右旋转摇匀B、上下颠到反复摇匀)
“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验。因其具有许多优点,已被广泛应用于化学实验中。下列三个实验均为“套管实验”,请观察、分析,回答下列问题: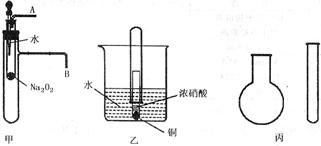
实验一:图甲是对课本有关Na2O2某性质的两个实验的改进。
⑴将胶头滴管中的水滴入小试管,然后,在导管口A、B处分别进行适当操作,再根据所观察现象可得到的两个结论是___________________,_________________。
⑵写出甲中反应的离子方程式_________________________________。
实验二:图乙是对铜和浓硝酸反应实验的改进。
⑶写出铜和浓硝酸反应的离子方程式为_________________________________。
⑷反应开始后,能观察到的现象是__________________________________,随后气体颜色逐渐变浅;大试管中液面上升。
⑸与普通演示实验相比,此实验除操作方便之外,还有_____________等优点。
实验三、现有下列药品:A.氯化铵固体,B.氢 氧化钠固体,C.浓氨水,D.浓硫酸,E.碳酸氢铵。采用“套管法”,只用一支试管(药匙等辅助用品略,不加热),选择合适的药品就可在圆底烧瓶中集满喷泉实验用的氨气(如图丙)。
氧化钠固体,C.浓氨水,D.浓硫酸,E.碳酸氢铵。采用“套管法”,只用一支试管(药匙等辅助用品略,不加热),选择合适的药品就可在圆底烧瓶中集满喷泉实验用的氨气(如图丙)。
⑹此实验制备氨气选用的最合适药品是__________(填序号)。
Fe3O4一种黑色粉末,又称磁性氧化铁,它的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
▲提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4;
假设3. ______________________________。
▲设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
⑴若假设1成立,则实验现象是________________。
⑵若所得溶液显血红色,则假设_________成立。
⑶为进一步探究,继续向所得溶液加入足量铁粉,若产生_______的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
⑷为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若产生__________现象,则假设2成立;若产生______________现象,则假设3成立。
粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ;②固定铁圈位置 ;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌; ⑤停止加热。其正确的操作顺序为。
(2)如何运用最简方法 检验溶液中SO42-是否除尽?。如果还有,应该如何除去SO42-离子?。
检验溶液中SO42-是否除尽?。如果还有,应该如何除去SO42-离子?。
(3)在粗盐经过溶解→过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的
 。
。
(4)将经过操作(3)后的溶液过滤。请问这一操作能除掉哪些杂质? 。
。
右图为实验室某浓盐酸试剂瓶标签上的有关数据,
试根据标签上的有关数据回答下列问题:
⑴该浓盐酸中HCl的物质的量浓度为 mol·L-1。 ⑵取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是。
⑵取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是。
| A.溶液中HCl的物质的量 | B.溶液的浓度 | C.溶液中Cl-的数目 | D.溶液的密度 |