对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
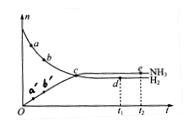
| A.NH3在点a’的正反应速率比点b’的正反应速率更小 |
| B.点c反应达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D.点e处c(NH3)不再变化 |
已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O  H+ +Cl- + HClO达到平衡后,要HClO浓度增大,可加入()
H+ +Cl- + HClO达到平衡后,要HClO浓度增大,可加入()
| A.Na 2SO3固体 | B.水 | C.CaCO3固体 | D.NaOH固体 |
已知下列数据
| 化学键 |
H—H |
Cl—Cl |
H—Cl |
| 生成(拆开)1mol化学键放出(吸收)的能量 |
436kJ |
243kJ |
431kJ |
则下列热化学方程式不正确的是
A、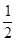 H2(g)+
H2(g)+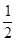 Cl2(g)="=HCl(g)" ;△H=-91.5kJ·mol-1
Cl2(g)="=HCl(g)" ;△H=-91.5kJ·mol-1
B、H2(g)+ Cl2(g)="=2HCl(g)" ;△H=-183kJ·mol-1
C、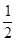 H2(g)+
H2(g)+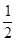 Cl2(g)="=HCl(g)" ;△H=+91.5kJ·mol-1
Cl2(g)="=HCl(g)" ;△H=+91.5kJ·mol-1
D、2HCl(g) ==H2(g)+ Cl2(g) ;△H=+183kJ·mol-1
近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是
| A.乙醇在电池的负极上参加反应 |
| B.1mol CH3CH2OH被氧化转移6mol e- |
| C.随着反应的进行,正极附近的酸性减弱。 |
| D.电池正极的正极反应为4H++O2+4e-=2H2O |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是()
| A.电池工作时,锌失去电子 |
| B.电池工作时,电子由正极通过外电路流向负极 |
| C.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| D.外电路中每通过O.2mol e-,锌的质量理论上减小6.5g |
下列溶液中,一定能大量共存的离子组是
| A.能使氢氧化铝迅速溶解的溶液: Na+、Fe2+、NO3—、SO42— |
| B.能使酚酞试液变红的溶液: Na+、NH4+、 CO32—、SO42— |
| C.含有大量SO42—的透明溶液: K+ 、Cu2+ 、Cl—、NO3— |
| D.含有大量ClO—的溶液: H+、 Mg2+、I—、SO42— |