现有四组溶液:①碘的饱和水溶液 ②汽油和氯化钠溶液 ③碳酸钙和水,分离以上各混合液的正确方法依次是
| A.萃取、分液、过滤 | B.萃取、分液、蒸馏 |
| C.分液、蒸馏、过滤 | D.蒸馏、萃取、过滤 |
将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图中实线所示。在相同的条件下,将b g(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )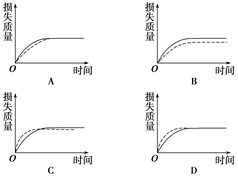
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图的所示.下列描述正确的是 ( )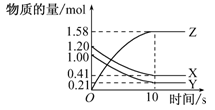
| A.从反应开始到10 s末,用Z表示的反应速率为0.158 mol/(L·s) |
| B.从反应开始到10 s末,用X表示的反应速率为0.79 mol/(L·s) |
| C.从反应开始到10 s末,Y的转化率为79.0% |
| D.该反应的化学方程式为X(g)+Y(g)=Z(g) |
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
负极,正极。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。(填序号)
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3、NO的体积比保持不变 | D.每消耗 1 mol SO2,同时生成1 mol NO |
当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为;
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为。
体积相同的密闭容器中均充入1 mol X和1mol Y,分别于300℃和500℃开始发生反应: X(g)+Y(g)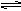 3Z(g),Z的含量(Z%)随时间t的变化如下图所示。
3Z(g),Z的含量(Z%)随时间t的变化如下图所示。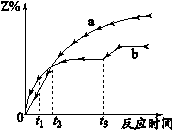
已知在t3时刻改变曲线b某一实验条件,下列判断正确的是
| A.曲线a是500℃时的图像 |
B.从0到t1时刻,反应物X(g)的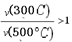 |
C.t2时刻生成物Z的量 |
| D.t3时刻改变的条件可能是降温 |
已知下列热化学方程式:
①C(s)+O2(g)==CO2(g)△H= —393.5kJ/mol
②CO(g)+ 1/2 O2(g)="=" CO2(g)△H= —283.0kJ/mol
③2Fe(s)+3CO(g)==Fe2O3(s)+3C(s) △H= —489.0kJ/mol
则4Fe(s)+3O2(g)==2Fe2O3(s)的反应热ΔH为()
| A.-1641.0kJ/mol | B.+3081kJ/mol |
| C.+663.5kJ/mol | D.-2507.0kJ/mol |