Ⅰ(只普通班做学生解答,答错题不给分)
(1)有下列四组物质①水、酒精、煤、石油 ②CaO、SO3、SO2、P2O5 ③HNO3、H2SO4、HCl、NaCl ④KClO3、KCl、KMnO4、HgO各组中均有一种物质所属类别与其他物质不同,这四种物质分别是:①__________;②______ __;③_______;④__________。
(2)将标准状况下22.4 L的HCl 溶于水配成200 mL的溶液,所得溶液的物质的量浓度为__________mol/L;
(3)3.01×1023个OH-的物质的量为___________mol,质量为___________g,含有电子的物质的量为___________mol,这些OH-与___________mol NH3的质量相同.
某种ABS工程树脂,由丙烯腈(CH2= CHCN,符号A)、1,3-丁二烯(符号B,CH2="CHCH=" CH2)和苯乙烯(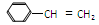 ,符号S),按一定配比共聚而得。
,符号S),按一定配比共聚而得。
(1)A、B和S 三种单体中,碳氢比(C﹕H)值最小的单体是。
(2)经元素分析知该ABS样品的组成为CaHbNc(a、b、c为正整数),则原料中A和B的物质的量之比是(用a、b、c)。
科学家把药物连接在高分子载体上制成缓释长效药剂。阿斯匹林结构为: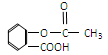 ;它可以连接在一高聚物载体上,形成缓释长效药剂,其中一种的结构简式为:
;它可以连接在一高聚物载体上,形成缓释长效药剂,其中一种的结构简式为: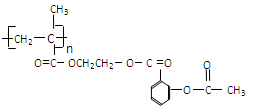
试回答:
(1)缓释长效阿司匹林的载体的结构简式为。
(2)服药后在人体内通过水解作用,可以缓慢地释放出阿司匹林,写出这个水解的化学方程式:。
(3)这种高分子载体是由单体发生聚合反应得到的。写出单体的结构简式。
Nomex纤维是一种新型的阻燃纤维。它可由间苯二甲酸和间苯二胺在一定重要条件下以等物质的量缩聚而成。请把Nomex纤维结构简式写在下面的横线上。

现有下列10种有机物:①淀粉、②油脂、③聚苯乙烯、④聚乙烯、⑤有机玻璃、⑥淀粉酶、⑦聚四氯乙烯、⑧蚕丝、⑨硅橡胶、⑩腈纶。
(1)属于天然有机高分子化合物的是;
(2)属于合成有机高分子化合物的是。
磷是存在于自然界和生物体内的的重要元素。回答下列与磷及其化合物有关的问题。
(1)磷在自然界里主要以的形式存在于矿石中,这些磷矿石溶于水,其中的磷元素被作物吸收。
(2)磷(相对原子质量为31)在空气中燃烧生成的氧化物通常可用做强干燥剂。制备100g这种干燥剂所消耗的空气的体积约为L(在标准状况下)。
(3)有机磷农药“乐果”的结构简式是: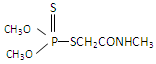 ,其中所含的双键有个。
,其中所含的双键有个。