Ⅱ[只辅导班(1,2,17班)学生解答,答错题不给分)]
(1)相同体积、相同物质的量浓度的AgNO3溶液,分别与相同体积的KCl、CuCl2、AlCl3溶液反应恰好完全反应,则KCl、CuCl2、AlCl3三种溶液的物质的量浓度之为
(2)M(NO3)2热分解化学方程式为2M(NO3)2 ="=" 2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是_____________________
(3)现有一种铜和氧化亚铁的混合物样品。为测定该样品中氧化亚铁的含量,某学生取20.0g此样品置于烧杯中,分四次加入密度为1.22g/cm3的硫酸并作相关记录。有关数据记录如下表:
| 加硫酸的序号 |
加硫酸的体积/mL |
剩余固体的质量/g |
| 1 |
20.0 |
16.0 |
| 2 |
20.0 |
12.0 |
| 3 |
20.0 |
8.0 |
| 4 |
20.0 |
8.0 |
试计算:①10.0g此样品中铜的物质的量 ②样品中氧化亚铁的质量分数 ③所用硫酸溶液溶质的物质的量浓度 。
(4)液态CS2能够在O2中燃烧生成CO2和SO2两种气体,今用0.228 g CS2在448 mL氧气(标准状况)中完全燃烧,反应后混合气体的平均摩尔质量是_______________。
(共4分)用系统命名法给下列物质命名:
(1)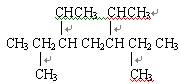
(2) 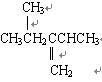
(14分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应)。某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:电解时,粗铜应与电源的 _极相连,阴极上的电极反应式为
电解过程中,硫酸铜的浓度会(选填:变大、不变、变小)。步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:
。
残渣含有极少量的黄金。为了回收金,他们查阅了有关资料(见下表):
| 序号 |
反应 |
化学平衡常数 |
| 1 |
Au + 6HNO3(浓)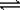 Au(NO3)3 + 3NO2↑+ 3H2O Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
| 2 |
Au3+ + 4Cl- ="" AuCl4- |
>>1 |
从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你从化学平衡移动的角度简要解释金能够溶于王水的原因
。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:
则100mL滤液中Cu2+的浓度为mol·L-1,Fe2+的浓度为mol·L-1
(10分) (1)在一定条件下,容积为 10 L密闭容器中发生反应:
CH4(g)+H2O(g) 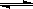 CO(g)+3H2(g);ΔH>0
CO(g)+3H2(g);ΔH>0
将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器 3 s时有0.1 mol CO生成,则3 s内该反应的平均速率v(H2)=。
(2)在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2amol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) 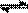 CH3OH(g)。CO的转化率与温度、压强的关系如图。
CH3OH(g)。CO的转化率与温度、压强的关系如图。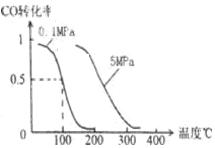
①该反应是反应(填“放热”或“吸热”)。
②150℃时该反应的平衡常数KV2/a2(填“=”“<”或“>”)。
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,和b mol CH3OH(g),则达到新平衡时,CO的转化率(填“增大”、“减小”或“不变”或“无法确定”),平衡常数(填“增大”、“减小”或“不变”)。
(4分)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向
AgCI和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化成黑色固体的化学方程式: ▲。
(2)白色固体转化成黑色固体的原因是: ▲。
如图所示,600K时,在容积可变的透明容器内,反应2HI(气) I2(气)+H2(气)达到平衡状态A。保持温度不变,将容器的容积压缩成为原容积的一半,达到平衡状态B。按图示观察方向__▲__(填“能”或“不能”)看出两次平衡时容器内颜色深浅的变化,理由是_▲__。若从水平方向观察,能否看到容器内颜色深浅的变化__▲___。
I2(气)+H2(气)达到平衡状态A。保持温度不变,将容器的容积压缩成为原容积的一半,达到平衡状态B。按图示观察方向__▲__(填“能”或“不能”)看出两次平衡时容器内颜色深浅的变化,理由是_▲__。若从水平方向观察,能否看到容器内颜色深浅的变化__▲___。