除去下表中各物质(C为溶液)中的少量杂质,所选用的试剂、方法正确的是
| 编号 |
物质 |
杂质(少量) |
试 剂 |
除杂操作方法 |
| A |
NaCl |
MgCl2 |
KOH溶液 |
— |
| B |
Fe |
Cu |
盐酸 |
过滤 |
| C |
FeSO4 |
CuSO4 |
过量铁粉 |
过滤 |
| D |
CO2 |
CO |
— |
点燃 |
下列物质的类别与所含官能团都正确的是()
A.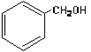 酚类–OH 酚类–OH |
B.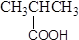 羧酸 –CHO 羧酸 –CHO |
C.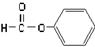 醛类 –CHO 醛类 –CHO |
D.CH3-O-CH3醚类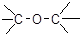 |
为了减少大气污染,许多城市推广清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气。这两类燃料的主要成分是()
| A.碳水化合物 | B.碳氢化合物 | C.氢气 | D.醇类 |
2005年,全球发生了禽流感。我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构式为: 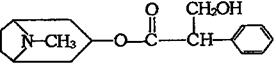
下列有关金丝桃素说法错误的是:( )
| A.分子式为C17H23NO3 |
| B.可以发生加成、酯化等反应 |
| C.苯环上的一氯取代物有3种 |
| D.金丝桃素常温常压下为气态 |
有一环状化合物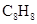 ,它不能使含溴的
,它不能使含溴的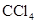 溶液褪色,它的分子中碳环上的一个氢原子被氯取代后的衍生物只有一种.这种环状化合物可能是( )
溶液褪色,它的分子中碳环上的一个氢原子被氯取代后的衍生物只有一种.这种环状化合物可能是( )
A.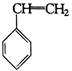 |
B. |
C.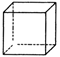 (立方烷) (立方烷) |
D.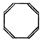 |
鲨鱼是世界上唯一不患癌症的动物,因其体内含有一种角鲨烯,具有抗癌性。该分子中含有30个碳原子及6个C=C键,且不含环状结构,则其分子式为( )
| A.C30H60 | B.C30H56 | C.C30H52 | D.C30H50 |