以NA代表阿伏加德罗常数,则关于反应:C2H2(g)+ 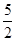 O2(g) =2CO2(g)+H2O(1);△H=-1300kJ/mol下列说法中,正确的是
O2(g) =2CO2(g)+H2O(1);△H=-1300kJ/mol下列说法中,正确的是
| A.有10NA个电子转移时,该反应吸收1300kJ的能量 |
| B.有NA个水分子生成且为液态时,吸收1300kJ的能量 |
| C.有NA个碳氧共用电子对形成时,放出1300kJ的能量 |
| D.有8NA个碳氧共用电子对形成时,放出1300kJ的能量 |
某气态有机物X只含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需的最少条件是( )
①X中含碳质量分数
②X中含氢质量分数
③X在标准状况下的体积
④质谱确定X的相对分子质量
⑤X的质量
A.①② B.①②④C.①②⑤D.③④⑤
下列化合物中,核磁共振氢谱只出现两组峰且峰面积之比为3:1的是( )
某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:2,则( )
A.分子中C、H、O个数之比为1:2:3
B.分子中C、H个数之比为1:2
C.分子中可能含有氧原子
D.此有机物的最简式为CH4
2014年度诺贝尔化学奖授予了研制出超高分辨率荧光显微镜的三位科学家。该仪器可用于研究细胞结构和功能等。则下列有关仪器分析说法中错误的是( )
| A.原子吸收光谱仪可用于测定物质中的金属元素 |
| B.质谱仪不能用于分析有机化合物的结构 |
| C.红外光谱仪可用于测定有机化合物的官能团 |
| D.氢核磁共振仪能鉴别CH3COOCH2CH3与CH3CH2COOCH3 |
甲醚和乙醇互为同分异构体,其鉴别可采用化学方法或物理方法,也可以使用仪器鉴定法,下列鉴别方法,不能对二者进行区别的是( )
| A.加入金属钠 | B.利用质谱法 |
| C.燃烧法 | D.利用核磁共振氢谱仪 |