实验室制取气体时所需的一些装置如图所示,请回答下列问题:
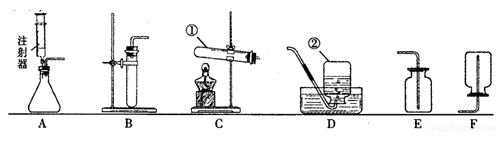
(1)写出指定仪器的名称:① ; ② ;
(2)小明同学选择C装置用氯酸钾和二氧化锰制取一瓶干燥的氧气,他应选择的收集装置是 (填字母);在该反应中MnO2可以重复使用,理由是 .
(3)小华同学想用高锰酸钾为原料来制取一瓶较纯净氧气,应选择的发生装置是 (填字母),收集装置是 .反应的文字表达式是 ,属于 (填基本反应类型)。
(4)实验室在常温下用块状电石与水反应制取不易溶于水的乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放热引起发生装置炸裂.你认为上图中最适合制取乙炔气体的发生装置是 (填字母)。
高氯酸钾(KClO4)是一种性能稳定的物质,主要用作发烟剂、引火剂、氧化剂和化学分析试剂,工业生产上生产的高氯酸钾的工艺流程如图:
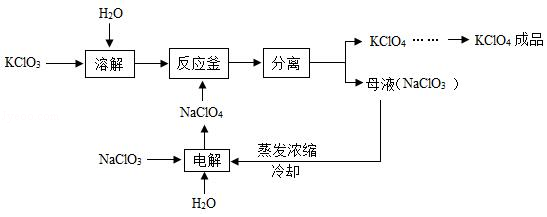
回答下列问题:
(1)为加快氯酸钾的溶解,可采取的措施为 。
(2)流程中的分离操作相当于实验室中的 。
(3)反应釜中发生的化学反应方程式为 ,该反应属于基本反应类型中的 反应。
(4)电解NaClO3溶液时,除产生NaClO4外,还得到一种清洁的高能燃料,该反应的化学方程式为 。
科学家研制出一种新型的催化剂,可用于去除装修残留的甲醛(CH2O),该反应过程的微观示意图如图:
回答下列问题:
(1)该反应的化学方程式为 。
(2)一种常见的营养物质,与CH2O的组成元素及分子中的各元素原子的个数比均相同,该营养物质的化学式为 。
如图是甲、乙两种固体(均不含结晶水)的溶解度曲线,由图可知:
(1)40℃时的溶解度大小甲 乙(填“>”、“=”或“<”)。
(2)40℃时甲的饱和溶液中溶质与溶剂的质量之比为 。
(3)将40℃时乙的饱和溶液140g冷却到20℃,析出固体乙 g。

化学与人类生活、生产活动息息相关,根据所学化学知识回答下列问题:
(1)用洗涤剂洗去餐具上的油污会产生 现象。
(2)打开汽水瓶盖时,汽水会自动喷出来,这说明气体在水中的溶解度与 有关。
(3)世界卫生组织于1989年把铝元素定位食品污染源之一。易拉罐表面的含有铝的氧化物 (填化学式),需要加以适当控制。
化学用语是学习化学的必备工具。用化学用语填空:
(1)可用于制造低温环境的氦气的化学式为 。
(2)氮元素是农作物生长所需的一种营养素,其原子结构示意图为 。铵态氮肥都含有铵根离子 、与碱反应产生氨气 ,氨气可用湿润的pH试纸检验,因为氨气遇水产生了氨水 ,在上述三种含氮物质里氮元素化合价均为 。