已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)= 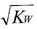 mol.L-1 mol.L-1 |
| D.混合溶液中c(H+)+c(B+)=c(OH-)+C(A-) |
下列关于配位化合物的叙述中,不正确的是( )
| A.配位化合物中必定存在配位键 |
| B.配位化合物中只有配位键 |
| C.[Cu(H2O)4]2+中的Cu2+提供空轨道,H2O中的O原子提供孤对电子,两者结合形成配位键 |
| D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有广泛的应用 |
下列说法正确的是()
| A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的 |
| B.H2O与H2S的空间结构一样是由共价键的饱和性决定的 |
| C.并非所有的共价键都有方向性 |
| D.两原子轨道发生重叠后,电子在两核间出现的概率减小 |
下列分子中,杂化类型相同,空间构型也相同的是( )
| A.H2O、SO2 | B.BeCl2、CO2 | C.H2O、NH3 | D.NH3、CH2O |
下列分子中划横线的原子采取的杂化方式为 sp杂化的是( )
| A.CH4 | B.C2H4 | C.C2H2 | D.NH3 |
下列推断正确的是( )
| A.BF3是三角锥形分子 |
B. 的电子式: 的电子式: ,离子呈平面形结构 ,离子呈平面形结构 |
| C.CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键 |
| D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H σ键 |