下列有关电解质溶液的说法正确的是
| A.Na2SO3溶液加水稀释后,pH和KW均减小 |
| B.0.1mol•L﹣1Na2CO3溶液中:c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3) |
| C.浓度分别为0.2mol•L﹣1和0.1mol•L﹣1的CH3COOH溶液中,c(H+)之比等于2:1 |
| D.室温下,PH=12的氨水与PH=2的H2SO4溶液等体积混合后,溶液呈酸性 |
在体积可变的容器中发生反应N2 + 3H2  NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是
NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是
| A.分子运动速率加快,使反应物分子间的碰撞机会增多 |
| B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
| C.活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多 |
| D.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞 |
下列四个数据是不同条件下测出的合成氨的反应的速率,其中最快的是
| A.v(NH3)=0.15 mol/L·min | B.v(H2)=0.1 mol/L·min |
| C.v(N2)=0.1 mol/L·min | D.v(N2)=0.002 mol/L·s |
在恒温恒容条件下,能使A(g)+B(g) C(g)+D(g)正反应速率瞬间增大的措施是
C(g)+D(g)正反应速率瞬间增大的措施是
| A.减小C或D的浓度 | B.增大D的浓度 |
| C.减小B的浓度 | D.增大A或B的浓度 |
反应2SO2+O2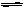 2SO3,经一段时间后,SO3的浓度增加了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为
2SO3,经一段时间后,SO3的浓度增加了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为
| A.0.1 s | B.2.5 s | C.5 s | D.10 s |
100 mL浓度为2 mol・L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入适量的6 mol・L-1的盐酸 | B.加入数滴氯化铜溶液 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |