H3AsO3与SnCl2在浓盐酸中可发生以下反应:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3M+6H2O关于该反应的说法中正确的组合是
①氧化剂是H3AsO3
②还原性:As>SnCl2
③每生成1 mol As,反应中转移电子的物质的量为3 mol
④M为OH-
⑤SnCl62-是氧化产物
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.只有①③ |
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图,下列叙述不正确的是()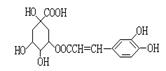
| A.咖啡鞣酸与浓溴水既能发生取代反应又能发生加成反应 |
| B.咖啡鞣酸分子中与苯环直接相连的原子都在同一平面上 |
| C.1 mol咖啡鞣酸在碱性条件下水解时,可消耗8 mol NaOH |
| D.咖啡鞣酸的分子式为C16H18O9 |
下列表示对应化学反应的离子方程式正确的是()
| A.向含有Fe2O3悬浊液中通入HI: Fe2O3 + 6H+= 2Fe3+ + 3H2O |
| B.NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀:2H++ SO42-+Ba2++2OH—=BaSO4↓+2H2O |
| C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.将1 mol/L NaAlO2溶液和1.5 mol/L HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
下列有机化合物中均含有酸性杂质,除去这些杂质的方法中正确的是()
| A.乙酸丁酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液 |
| B.乙醇中含乙酸杂质:加入碳酸钠溶液洗涤,分液 |
| C.乙醛中含乙酸杂质:加入氢氧化钠溶液洗涤,分液 |
| D.苯中含苯酚杂质:加入溴水, |
向10mL 0.1mol·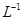
 溶液中,滴加等浓度
溶液中,滴加等浓度 溶液x mL,下列叙述正确的是()
溶液x mL,下列叙述正确的是()
A.x=10时,溶液中有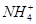 、 、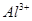 、 、 ,且 ,且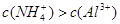 |
B.x=10时,溶液中有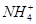 、 、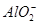 、 、 ,且 ,且 |
C.x=30时,溶液中有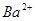 、 、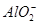 、 、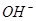 ,且 ,且 |
D.x=30时,溶液中有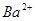 、 、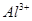 、 、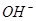 ,且 ,且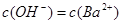 |
在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数为w=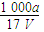 ×100% ×100% |
B.溶质的物质的量浓度c=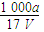 mol·L-1 mol·L-1 |
C.溶液中c(OH-)=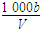 mol·L-1 mol·L-1 |
| D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |