某同学设计如下图所示装置,探究氯碱工业原理,下列说法正确的是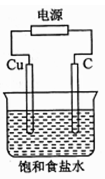
| A.石墨电极与直流电源负极相连 |
| B.用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色 |
| C.氢氧化钠在石墨电极附近产生, Na+向石墨电极迁移 |
| D.铜电极的反应式为:2H++ 2e-= H2↑ |
若醋酸用HAc表示,则在0.1mol·L-1 NaAc溶液中,下列离子浓度关系正确的是
| A.c(Na+)= c(Ac—)+c(HAc) |
| B.c(Na+)+c(OH—)= c(Ac—)+c(H+) |
| C.c(Na+)>c(OH—) > c(Ac—) > c(H+) |
| D.c(Na+)> c(Ac—)> c(H+)> c(OH—) |
某小组为研究电化学原理,设计如图装置。下列叙述错误的是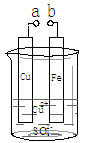
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.a和b分别连接足够电压的直流电源正、负极时,Cu2+向铜电极移动 |
| D.无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐渐变成浅绿色 |
下列表述中,合理的是
| A.将水加热,Kw增大,pH不变 |
| B.把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 |
下图为一原电池的结构示意图,下列说法中,错误的是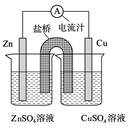
| A.Cu电极为正电极 |
| B.原电池工作时,电子从Zn电极流出 |
| C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液 |
一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取
的措施是
| A.加入少量稀NaOH溶液 | B.加入少量CH3COONa固体 |
| C.加入少量NH4HSO4固体 | D.加入少量Na2CO3浓溶液 |