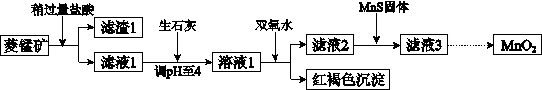
工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
已知:生成氢氧化物沉淀的pH
| |
Mn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
Cu(OH)2 |
| 开始沉淀时 |
8.3 |
6.3 |
2.7 |
4.7 |
| 完全沉淀时 |
9.8 |
8.3 |
3.7 |
6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是 。
盐酸溶解MnCO3的化学方程式是 。
(2)向溶液1中加入双氧水时,反应的离子方程式是 。
(3)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□H2O=□Cl2+□________+□________。
(4)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是 。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是 。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是 。
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
①向该待测液中加入过量的稀盐酸,有白色沉淀生成。
②过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
③过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
④另取少量步骤③中的滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)待测液中一定含有 离子,一定不含有 离子。
(2)还有一种离子无法确定是否存在,检验该离子实验方法的名称是 观察到的现象是 。
Ⅰ:中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O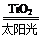 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O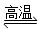 CO+ 3H2
CO+ 3H2
(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。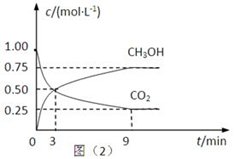
①从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
Ⅱ:甲醇是一种可再生能源,具有广泛的开发和应用前景。
(3)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g) + 2H2(g) 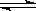 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g) + 3H2(g) 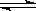 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②已知反应Ⅰ的能量变化如图所示:由表中数据判断ΔH1 0(填“>”、“=”或“<”)。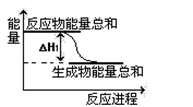
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L, 则CO的转化率为 。
(4)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。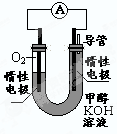
①该电池正极的电极反应为____________
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为____________.
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程如下: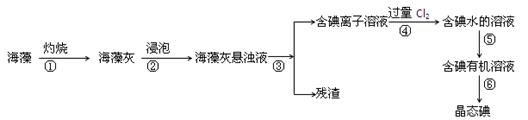
(1)指出上述提取碘的过程中有关实验操作的名称:
步骤③ ,步骤⑤ 。
(2)写出步骤④对应反应的离子方程式: 。
(3)步骤④除了加入过量Cl2,下列氧化剂最好选用 (填代号)。
A.浓硫酸 B.H2O2溶液 C.KMnO4溶液
理由是 。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示。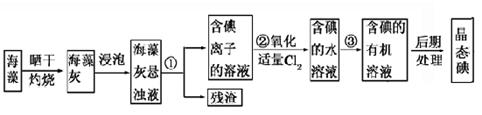
(1)指出提取碘的过程中有关的实验操作名称:①________________,③_______________。
写出实验②中有关反应的离子方程式:_________________________________。
(2)提取碘的过程中,可供选择的有关溶剂是________________________。
| A.甲苯,酒精 | B.四氯化碳,苯 |
| C.汽油,乙酸 | D.汽油,乙二醇 |
(3)为了使海藻灰中碘离子转化为碘的有机溶液,实验室准备了烧杯、玻璃棒、锥形瓶、酒精灯、导管、圆底烧瓶,石棉网以及必要的夹持仪器、物品。如上流程图所示,还缺少的玻璃仪器是_________________________。
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出下图实验装置中的错误之处: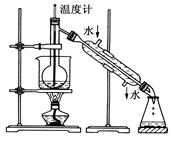
①______________________;
②__________________________;
③________________________。
(5)进行上述蒸馏法操作时,使用水浴的原因是_______________;最后,晶态碘在__________________里聚集。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。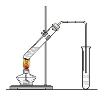
回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是 。
(3)浓硫酸的作用是:① ;② 。
(4)饱和碳酸钠溶液的主要作用是
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化