下列有关NA的说法正确的是
| A.18g D2O和18g H2O中含有的质子数均为10NA |
| B.2L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2NA |
| C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
| D.标准状况下,2.24L Cl2与过量的稀FeI2溶液反应,转移电子总数为0.1NA |
降低下列溶液的pH,而难溶电解质的溶解度保持不变的是
| A.Al(OH)3 | B.PbCl2 | C.Ag3PO4 | D.ZnCO3 |
下列溶液中微粒的物质的量浓度关系正确的是
| A.0.1mol/LNaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| B.室温下,向0.01mol/LNH4HSO4溶液中滴加等体积0.01mol/LNaOH溶液: c(Na+)=c(SO42-)>c(NH4+).>c(H+)>c(OH-) |
| C.Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) |
| D.25℃时,浓度均为0.1mol/L的CH3COOH和CH3COONa等体积混合: |
c(CH3COOH)+c(CH3COO-)=0.2mol/L
银锌(Ag—Zn)可充电电池广泛用做各种电子仪器的电源,电解质为KOH。其电池总反应式为Ag2O + Zn + H2O  2Ag + Zn(OH)2,下列说法正确的是
2Ag + Zn(OH)2,下列说法正确的是
| A.放电时Zn参与反应的电极为正极 |
| B.放电时负极附近的pH逐渐增大 |
| C.充电时阴极的电极反应为:Zn(OH)2 -2e-= Zn + 2OH- |
| D.充电时每生成1 mol Ag2O转移2 mol电子 |
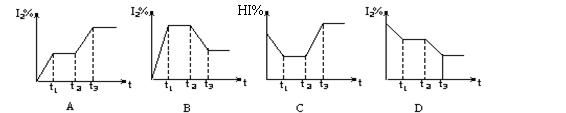
在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g)H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是
| A.CuSO4粉末 | B.K2 SO4固体 | C.(NH4)2 SO4粉末 | D.CH3COONa固体 |