下列溶液中各微粒的浓度关系正确的是
| A.pH=4的盐酸中:c(H+)=4.0mol·L-1 |
| B.NH4Cl溶液中:c(Cl-)=c(NH4+) |
| C.NaCl溶液中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D.Na2CO3溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=2c(Na+) |
下列图中的实验方案,能达到实验目的的是
| A |
B |
C |
D |
|
| 实验方案 |
 |
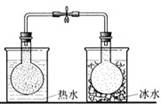 将NO2球浸泡在冰水和热水中 |
 |
 |
| 实验 目的 |
验证FeCl3对H2O2分解反应有催化作用 |
探究温度对平衡 2NO2(g)  N2O4(g)的影响 N2O4(g)的影响 |
除去CO2气体中混有的HCl |
用酒精萃取溴水中的溴 |
下列指定反应的离子方程式正确的是
| A.4mol·L-1的NaAlO2溶液和7mol·L-1的HCl等体积互相均匀混合AlO2-+ H+ + H2O = Al(OH)3↓ |
| B.NH4HCO3溶液中加入过量的NaOH溶液:HCO3-+OH-=CO32-+ H2O |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.向Ba(OH)2溶液中滴加硫酸氢钠至溶液为中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
440℃时反应:2E(g) + F(g) 2G(g)△H。在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入E(g)和F(g),经5min达到平衡。其起始物质的量及E的平衡转化率如下表所示。
2G(g)△H。在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入E(g)和F(g),经5min达到平衡。其起始物质的量及E的平衡转化率如下表所示。
| 甲 |
乙 |
丙 |
||
| 起始物质的量 |
n(E)/mol |
0.4 |
0.8 |
0.8 |
| n(F)/mol |
0.24 |
0.24 |
0.48 |
|
| E的平衡转化率 |
80% |
α1 |
α2 |
|
下列判断中,错误的是
A.5min内甲中E的平均反应速率为0.032mol·L-1·min-1
B.甲容器中若混合气体的平均相对分子质量不变则该反应达到平衡状态
C.平衡时,E的转化率:α1<80%<α2
D.若温度为500℃时,测得该反应的平衡常数K=100,则△H>0
下列溶液中粒子的物质的量浓度关系正确的是
| A.某溶液中存在的离子有S2—、HS—、OH—、Na+、H+,则离子浓度的大小关系一定是:c(Na+)>c(S2—)>c(OH—)>c(HS—)>c(H+) |
| B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)=c(OH-)+c( HC2O4-)+ 2c( C2O42-) |
| D.0.l mol·L-1的NaHCO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.0.2mol/LNa2S溶液中含有S2-数目小于0.2NA |
| B.60g SiO2中含有NA个SiO2分子 |
| C.标准状况下,22.4LCl2溶于水,转移的电子数目为0.1NA |
| D.电解精炼铜时,当阴极上质量增加6.4g时,电路上转移的电子数目为0.2NA |