工业制氢气的一个重要反应是: 已知在25℃时:
已知在25℃时: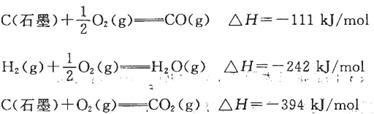
则2 5℃时1 mol CO与水蒸气作用转化为氢气和二氧化碳反应△H为
| A.+41.kJ/mol | B.-41kJ/mol | C.283kJ/mol | D.-131kJ/mol |
把HI气体充入密闭容器中,在一定条件下发生反应: 2HI(g) H2(g)+I2(g)反应趋向平衡状态的过程中,下列说法正确的是
H2(g)+I2(g)反应趋向平衡状态的过程中,下列说法正确的是
| A.HI的生成速率等于其分解速率 |
| B.HI的生成速率小于其分解速率 |
| C.HI的生成速率大于其分解速率 |
| D.无法判断HI的生成速率和分解速率的相对大小 |
下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快的是
| A.V(H2)==0.1mol/(L·min) |
| B.V(N2)==0.1mol/(L·min) |
| C.V(NH3)==0.15mol/(L·min) |
| D.V(N2)==0.002mol/(L·s) |
用铁片与稀硫酸反应制取氢气时,下列措施能使氢气生成速率加大的是
| A.加少量CH3COONa固体 |
| B.加水 |
| C.不用稀硫酸,改用98%浓硫酸 |
| D.不用铁片,改用铁粉 |
本题列举的四个选项是4位同学在学习“化学反应的速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
| A.增加CO的物质的量 |
| B.将容器的体积缩小一半 |
| C.保持体积不变,充入N2使体系压强增大 |
| D.保持压强不变,充入N2使容器体积变大 |