设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25NA |
| B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
| C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
D.5NH4NO3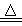 2HNO3+4N2↑+9H2O反应中,生成56g N2时,转移的电子数目为3.75NA 2HNO3+4N2↑+9H2O反应中,生成56g N2时,转移的电子数目为3.75NA |
中学阶段介绍的应用电解法制备的物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠的制备。下列关于这三个工业生产的描述中正确的是
| A.电解法制金属钠时,负极反应式:Na++e-===Na |
| B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性 |
| C.在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生 |
| D.氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是Cl-失电子 |
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:_____________________(用化学反应方程式表示)。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
负极________,正极________。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。(填序号)
| A.体系压强保持不变 |
| B.混合气体颜色保持不变 |
| C.SO3、NO的体积比保持不变 |
| D.每消耗 1 mol SO2,同时生成1 mol NO |
当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为_______;
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为_______。
市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li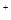 的高分子材料。这种锂离子电池的电池反应为:
的高分子材料。这种锂离子电池的电池反应为: Li+2Li
Li+2Li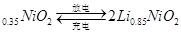
 下列说法不正确的是
下列说法不正确的是
A.放电时,负极的电极反应式:Li-e =Li =Li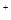  |
B.充电时,Li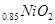 既发生氧化反应又发生还原反应 既发生氧化反应又发生还原反应 |
C.该电池不能用水溶液作为电解质 |
D.放电过程中Li 向负极移动 向负极移动 |
“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是
| A.电池反应中有NaCl生成 |
| B.电池的总反应是金属钠还原三价铝离子 |
| C.正极反应为:NiCl2+2e-=Ni+2Cl- |
| D.钠离子通过钠离子导体在两电极间移动 |
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是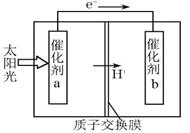
| A.该过程是将太阳能转化为化学能的过程 |
| B.催化剂a表面发生氧化反应,有O2产生 |
| C.催化剂a附近酸性减弱,催化剂b附近酸性增强 |
| D.催化剂b表面的反应是CO2 +2H++2e一=HCOOH |